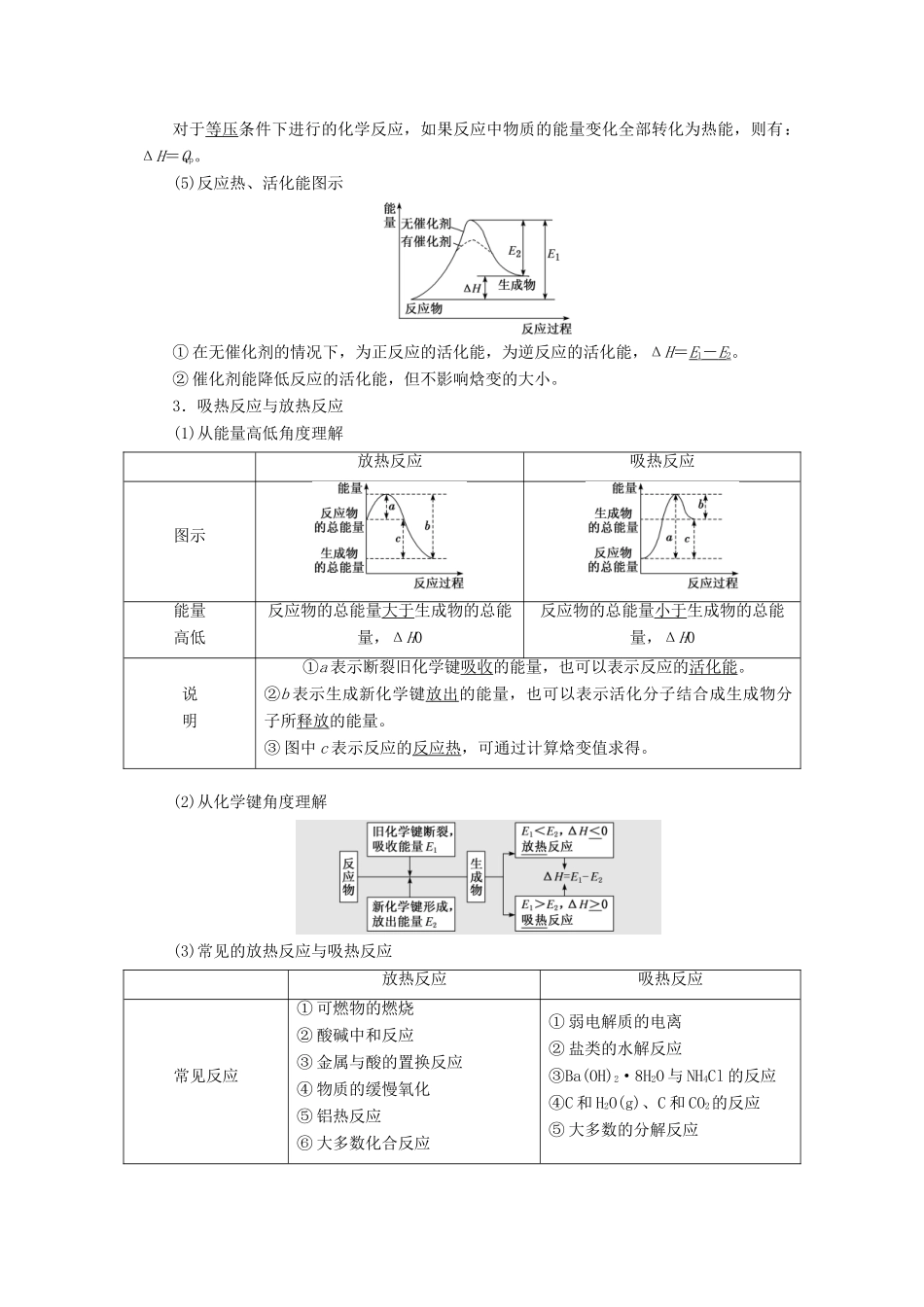
第五章化学反应与能量考试要求教学建议1.认识化学能可以与热能、电能等其他形式能量之间相互转化,能量的转化遵循能量守恒定律。2.认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应热可以用焓变表示。3.了解盖斯定律及其简单应用。4.认识化学能与电能相互转化的实际意义及其重要应用。5.了解原电池及常见化学电源的工作原理。6.了解电解池的工作原理,认识电解在实现物质转化和储存能量中的具体应用。7.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。一轮复习不能按部就班地循教材复习,否则会磨灭学生的积极性和创造力。本章将化学能与热能、化学能与电能整合在一起复习,有利于考生从根本上掌握“能量守恒”这一观点,贯通知识联系,形成知识体系。本章共设7课时,仍遵循由基础到能力,由单一到综合的编写路径。更难能可贵的是,由于本章知识与前沿科技热点结合比较紧密,高考更注重对创新问题的考查,故本章在编写时注重前沿热点问题的渗透和应用。第1课时化学能与热能(1)——基本概念一课过(过基础)知识点一焓变、热化学方程式1.化学反应的实质与特征2.焓变、反应热(1)焓(H)用于描述物质所具有能量的物理量。(2)焓变(ΔH)ΔH=H(生成物)-H(反应物),单位kJ·mol-1。(3)反应热当化学反应在一定温度下进行时,反应所放出或吸收的热量,通常用符号Q表示,单位kJ·mol-1。(4)焓变与反应热的关系对于等压条件下进行的化学反应,如果反应中物质的能量变化全部转化为热能,则有:ΔH=Qp。(5)反应热、活化能图示①在无催化剂的情况下,为正反应的活化能,为逆反应的活化能,ΔH=E1-E2。②催化剂能降低反应的活化能,但不影响焓变的大小。3.吸热反应与放热反应(1)从能量高低角度理解放热反应吸热反应图示能量高低反应物的总能量大于生成物的总能量,ΔH0反应物的总能量小于生成物的总能量,ΔH0说明①a表示断裂旧化学键吸收的能量,也可以表示反应的活化能。②b表示生成新化学键放出的能量,也可以表示活化分子结合成生成物分子所释放的能量。③图中c表示反应的反应热,可通过计算焓变值求得。(2)从化学键角度理解(3)常见的放热反应与吸热反应放热反应吸热反应常见反应①可燃物的燃烧②酸碱中和反应③金属与酸的置换反应④物质的缓慢氧化⑤铝热反应⑥大多数化合反应①弱电解质的电离②盐类的水解反应③Ba(OH)2·8H2O与NH4Cl的反应④C和H2O(g)、C和CO2的反应⑤大多数的分解反应[提醒]①化学反应的能量变化主要表现为放热或吸热,但这并不是唯一的表现形式,其他的还有发光、放电等。②化学反应表现为吸热或放热,与反应的条件没有必然关系,而是取决于反应物和生成物具有的总能量(或焓)的相对大小。③化学反应表现为吸热或放热,与反应开始时是否需要加热无关。需要加热的反应不一定是吸热反应,如C+O2=====CO2为放热反应;不需要加热的反应也不一定是放热反应,如Ba(OH)2·8H2O与NH4Cl的反应为吸热反应。4.热化学方程式(1)概念表示参加反应的物质的量和反应热关系的化学方程式。(2)意义不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。(3)书写步骤[对点训练]1.如图是化学反应中物质变化和能量变化的示意图。若E1>E2,则下列反应符合该示意图的是()A.NaOH溶液与稀盐酸的反应B.锌与稀盐酸的反应C.氢氧化钡与氯化铵固体的反应D.一氧化碳在空气中的燃烧反应解析:选C吸收的能量E1大于释放的能量E2,故该反应为吸热反应。NaOH溶液与稀盐酸的反应属于放热反应,故A错误;锌与稀盐酸的反应属于放热反应,故B错误;氢氧化钡与氯化铵固体的反应属于吸热反应,故C正确;一氧化碳在空气中的燃烧反应属于放热反应,故D错误。2.(2016·浙江4月选考)2A(g)B(g)ΔH1(ΔH1<0);2A(g)B(l)ΔH2;下列能量变化示意图正确的是()解析:选B反应的ΔH1<0,为放热反应,即反应物的能量高于生成物的能量,且物质由气态转变为液态时,也将放热。对照选项图像可知B项符合。3.(2015·浙江10月选考)已知1molCH4气体完全燃烧生成气态CO2和液态H2O,放出890.3kJ热量,则表示该反应的热化学方程式正确的是()A.CH4(g)+2O2(g)===CO2(...