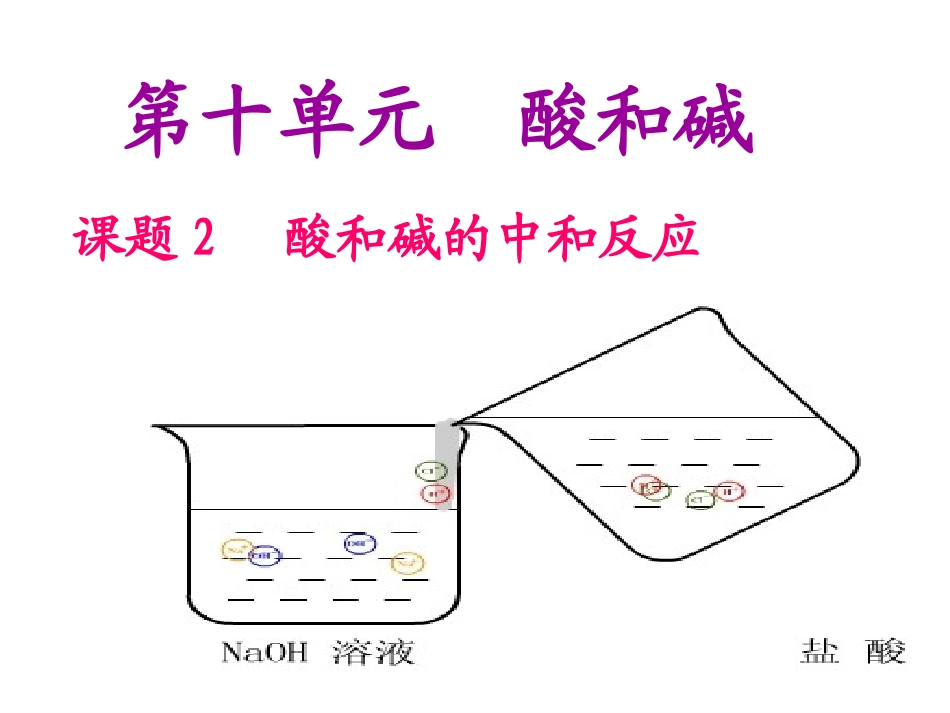
第十单元酸和碱课题2酸和碱的中和反应同学们有这样的经历吗?蜜蜂蛰伤蚊子叮咬蚊虫叮咬时,蚊子分泌出一种有机酸--蚁酸,在家庭中可用浓肥皂涂抹可迅速止痒。显碱性引言:前几节课,我们学习了常见的酸和碱,已掌握了它们的部分性质。例如:酸和碱都能与指示剂反应,使指示剂变色;酸能与活泼的金属与金属氧化物反应;碱能与非金属氧化物反应等。那么,酸和碱之间是否能发生反应呢?操作步骤现象和分析(1)在烧杯中加入5mL氢氧化钠溶液,滴入几滴酚酞溶液。(2)逐滴滴入稀盐酸,并不断搅拌。(3)取(1)中变为无色的溶液2滴滴在玻璃片上,置于酒精灯上加热。溶液由无色变红色溶液由红色变无色,放热温度升高活动与探究:玻璃片上有白色固体生成5课题2酸和碱的中和反应课题2酸和碱的中和反应【问题1】在实验过程中,溶液为什么先变红?为什么要加入酚酞指示剂?【问题2】【问题3】为何要逐滴滴加稀盐酸?并用玻璃棒不断搅拌?在溶液恰好变为无色的时候,溶液的酸碱性是怎样的?为什么要在溶液恰好变为无色时就停止加入盐酸?【问题4】城关一中陈老师借以判断反应有无发生通过以上的实验我们知道酸碱之间可以发生反应,但生成了什么物质呢?现在烧杯里面的溶液的溶质是什么?是NaOH?稀盐酸?还是其它物质?为什么?【问题5】为什么NaOH+HCl反应?生成什么?反应前后溶液中离子发生了怎样的变化?重新组合微观世界HCl+NaOHNaCl+H2O氢氧化钠与盐酸反应的本质:酸溶液中的氢离子和碱溶液中的氢氧根离子反应生成水的过程。中和反应的实质:+HCl+NaOHNaCl+H2OHCl+Ca(OH)2H2SO4+NaOHCaCl2+2H2ONa2SO4+2H2O22中和反应:酸和碱作用生成盐和水的反应。盐酸碱水++由金属离子和酸根离子构成22、反应实质、反应实质::一、中和反应:一、中和反应:11、定义:、定义:酸和碱作用生成盐和水的反应。酸和碱作用生成盐和水的反应。【练习】:完成下列方程式,并判断哪一个是中和反应CaCO3+HCl----CO2+NaOH----KOH+HNO3----H2SO4+Fe2O3----【注意】中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应H++OH-=H2O西谷中学化学组课题2酸和碱的中和反应二、中和反应在实际中的应用二、中和反应在实际中的应用加入酸性物质中性土壤中性土壤酸性土壤熟石灰Ca(OH)2盐碱地碱性土壤你会处理废水吗?某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?用碱性物质(例如熟石灰)进行中和处理。你能写出化学方程式吗?Ca(OH)2+H2SO4==CaSO4+2H2O⑴中和胃酸过多用含有氢氧化铝的胃药中和胃酸中过多的盐酸。化学方程式:Al(OH)Al(OH)33+3HCl+3HCl==AlClAlCl33+3H+3H22OO⑵中和蚁酸思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。添加食醋(CH3COOH)有什么方法可以测定溶液的酸碱度呢?酸碱指示剂可以检验溶液的酸碱性,但不能表示溶液酸碱性的强弱程度。溶液的酸碱性强弱程度叫做溶液的酸碱度。三.溶液酸碱度的表示法-pH1.pH的范围通常在0~14之间0714(越往右碱性越强)(越往左酸性越强)酸性溶液的PH<7碱性溶液的PH>7中性溶液的PH=7,酸性越强,PH越小,碱性越强,PH越大,如:NaCl溶液,Na2SO4溶液PH=7PH和溶液的酸碱性:酸性碱性中性PH试纸测定PH最简便的方法是:使用PH试纸2、用pH试纸测PH的方法:,在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH。3、PH试纸的正确使用方法:1、不能直接把试纸浸入试液,否则会污染试液。注意:2、不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确(偏大、不变、偏小)。3、用PH试纸测定PH值时,得到的结果一定是整数.身边一些常见物质的pH实验10-10:测定生活中一些物质的PH4、了解溶液的酸碱度有重要的意义①化工生产中许多反应必须在一定pH溶液里才能进行;②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;(PH<4为酸性土壤,PH>8为碱性土壤)③测定雨水的pH,可以了解空气的污染情况([注:正常雨水(含H2CO3)的pH约为5.6,酸...