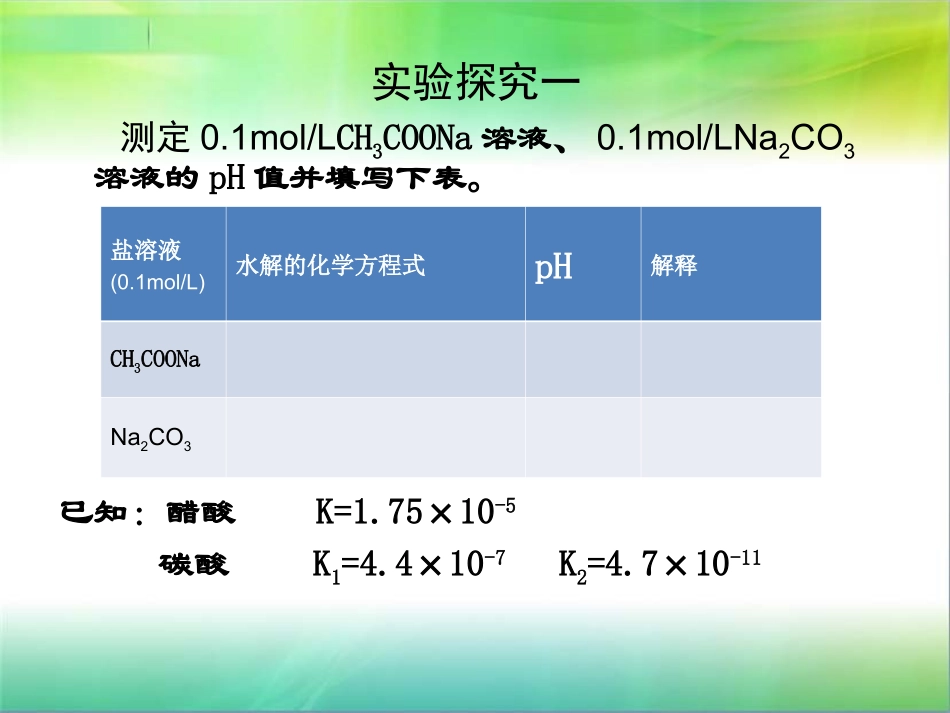
第三章水溶液中的离子平衡第三章水溶液中的离子平衡第三节盐类的水解第三节盐类的水解(第二课时)(第二课时)三、影响盐类水解的主要因素实验探究一测定0.1mol/LCH3COONa溶液、0.1mol/LNa2CO3溶液的pH值并填写下表。已知:醋酸K=1.75×10-5碳酸K1=4.4×10-7K2=4.7×10-11盐溶液(0.1mol/L)水解的化学方程式pH解释CH3COONaNa2CO3酸性:醋酸〉碳酸结论:盐对应的酸(或碱)越,水解程度越,溶液碱性(或酸性)越。弱大强三、影响盐类水解的主要因素1、内因:盐本身的性质(越弱越水解)实验探究二通过实验探究促进或抑制FeCl3水解的条件:取5只小试管,分别加入等量的0.1mol/LFeCl3溶液,第一只作对比实验,随后3只依次加热、加盐酸、加NaHCO3溶液,观察现象并记录。三、影响盐类水解的主要因素1、内因:盐本身的性质(越弱越水解)2、外在因素(1)温度:升高温度,水解程度增大。(2)浓度:加水稀释,可促进水解,但溶液酸性或碱性减弱。(3)外加试剂酸抑制强酸弱碱盐的水解碱抑制强碱弱酸盐的水解四、盐类水解反应的利用•日常生活中盐类的水解问题•化学实验中盐类的水解问题•物质制备中盐类的水解问题•农业生产中盐类的水解问题•其他1、日常生活中盐类的水解问题•热的碳酸钠溶液去油污升温可使水解平衡向正反应方向移动,提高了c(OH-),增强了去污力。•铁盐、铝盐作净水剂许多盐在水解时,可生成难溶于水的氢氧化物,当生成的氢氧化物呈胶状且无毒时,可用作净水剂。如明矾,硫酸铁等。2、化学实验中盐类的水解问题•配制和保存某些易水解盐溶液例:配制FeCl3溶液因生成难溶的Fe(OH)3而得不到澄清溶液,可加入少量盐酸以防止浑浊。•配制FeCl3、SnCl2等溶液时,先用少量浓盐酸溶解,再加水稀释到所需的浓度。•试剂瓶及瓶塞选用盛放Na2S、Na2CO3的试剂瓶为什么不能用玻璃塞?练习:练习:相同条件,相同物质的量浓度的下列溶液:相同条件,相同物质的量浓度的下列溶液:NNaa22COCO33、、NaClONaClO、、NaAcNaAc、、NaNa22SOSO44、、NaOHNaOH、、((NHNH44))22SOSO44等溶液,等溶液,pHpH值由大到小的顺序为:值由大到小的顺序为:。。•解析:解析:NaOH>NaClO>NaNaOH>NaClO>Na22COCO33>NaAc>Na>NaAc>Na22SOSO44>(NH>(NH44))22SOSO44