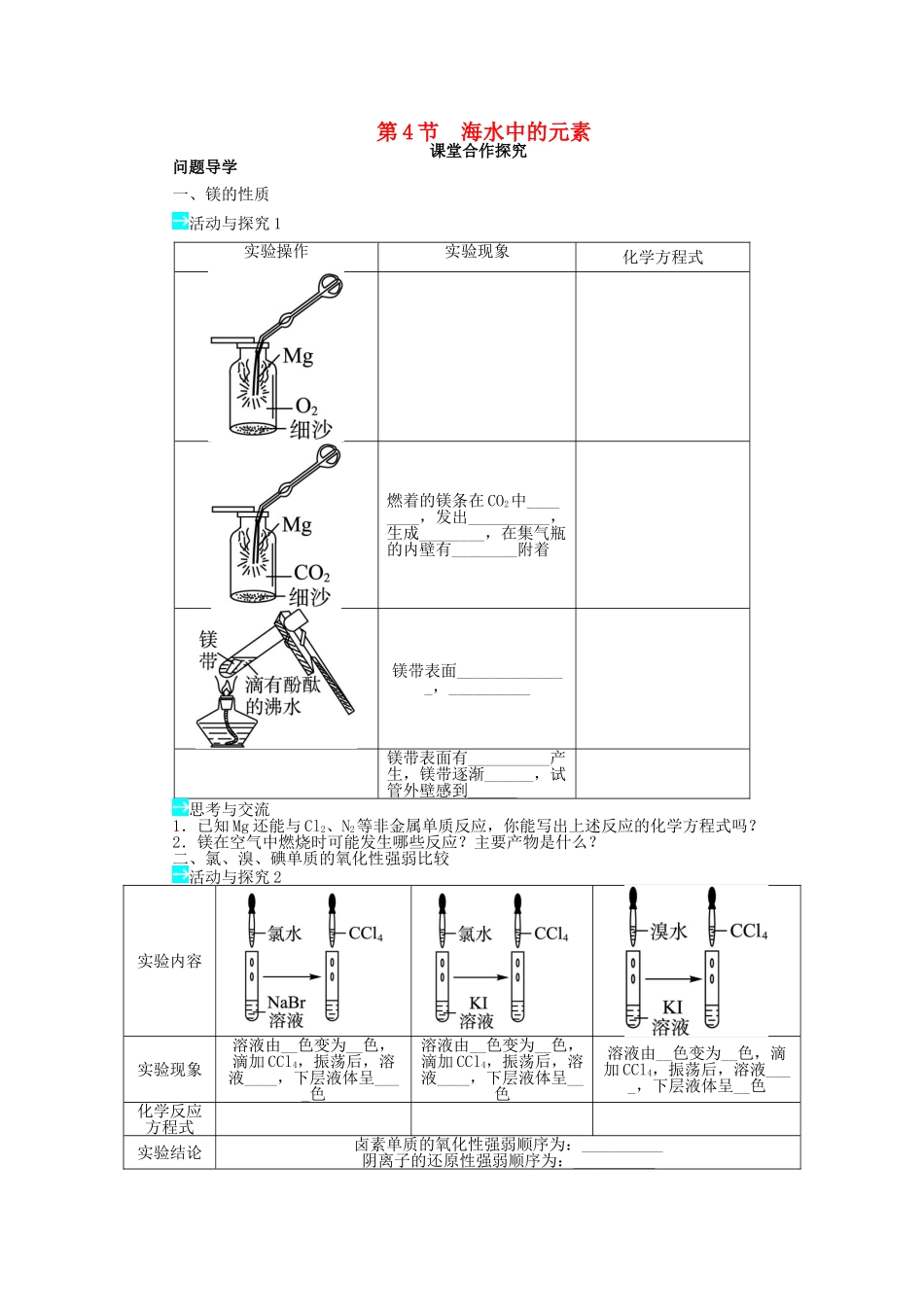
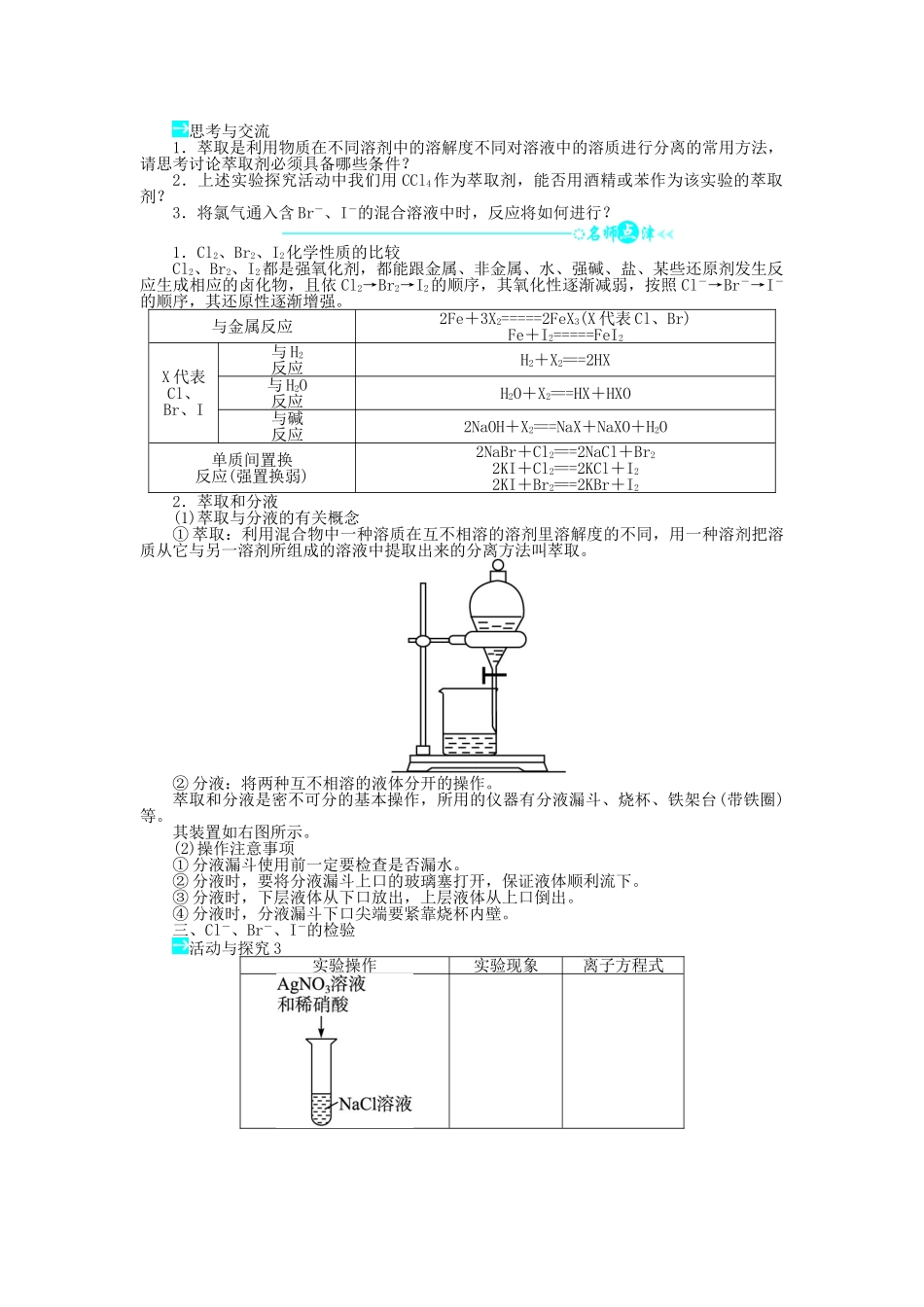
第4节海水中的元素课堂合作探究问题导学一、镁的性质活动与探究1实验操作实验现象化学方程式燃着的镁条在CO2中________,发出__________,生成________,在集气瓶的内壁有________附着镁带表面______________,__________镁带表面有__________产生,镁带逐渐______,试管外壁感到______思考与交流1.已知Mg还能与Cl2、N2等非金属单质反应,你能写出上述反应的化学方程式吗?2.镁在空气中燃烧时可能发生哪些反应?主要产物是什么?二、氯、溴、碘单质的氧化性强弱比较活动与探究2实验内容实验现象溶液由__色变为__色,滴加CCl4,振荡后,溶液____,下层液体呈____色溶液由__色变为__色,滴加CCl4,振荡后,溶液____,下层液体呈__色溶液由__色变为__色,滴加CCl4,振荡后,溶液____,下层液体呈__色化学反应方程式实验结论卤素单质的氧化性强弱顺序为:__________阴离子的还原性强弱顺序为:__________思考与交流1.萃取是利用物质在不同溶剂中的溶解度不同对溶液中的溶质进行分离的常用方法,请思考讨论萃取剂必须具备哪些条件?2.上述实验探究活动中我们用CCl4作为萃取剂,能否用酒精或苯作为该实验的萃取剂?3.将氯气通入含Br-、I-的混合溶液中时,反应将如何进行?1.Cl2、Br2、I2化学性质的比较Cl2、Br2、I2都是强氧化剂,都能跟金属、非金属、水、强碱、盐、某些还原剂发生反应生成相应的卤化物,且依Cl2→Br2→I2的顺序,其氧化性逐渐减弱,按照Cl-→Br-→I-的顺序,其还原性逐渐增强。与金属反应2Fe+3X2=====2FeX3(X代表Cl、Br)Fe+I2=====FeI2X代表Cl、Br、I与H2反应H2+X2===2HX与H2O反应H2O+X2===HX+HXO与碱反应2NaOH+X2===NaX+NaXO+H2O单质间置换反应(强置换弱)2NaBr+Cl2===2NaCl+Br22KI+Cl2===2KCl+I22KI+Br2===2KBr+I22.萃取和分液(1)萃取与分液的有关概念①萃取:利用混合物中一种溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的分离方法叫萃取。②分液:将两种互不相溶的液体分开的操作。萃取和分液是密不可分的基本操作,所用的仪器有分液漏斗、烧杯、铁架台(带铁圈)等。其装置如右图所示。(2)操作注意事项①分液漏斗使用前一定要检查是否漏水。②分液时,要将分液漏斗上口的玻璃塞打开,保证液体顺利流下。③分液时,下层液体从下口放出,上层液体从上口倒出。④分液时,分液漏斗下口尖端要紧靠烧杯内壁。三、Cl-、Br-、I-的检验活动与探究3实验操作实验现象离子方程式思考与交流实验室有KCl、KBr、KI三种无色溶液,如何将它们区分开来?检验Cl-、Br-、I-的两种方法1.沉淀检验法利用此法检验三种离子时,必须加入稀硝酸,目的是排除杂质离子的干扰。2.氧化检验法(主要针对Br-和I-的检验)当堂检测1.镁粉在焰火、闪光粉、鞭炮中是必不可少的原料,工业上制造镁粉是将镁蒸气在某种气体中冷却。现有下列气体:①空气②CO2③Ar④H2⑤N2,其中可作为冷却气体的是()A.①和②B.②和③C.③和④D.④和⑤2.已知氧化还原反应发生的条件是:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。又已知还原性强弱顺序是I->Br->Fe2+>Cl-(氧化性:Cl2>Fe3+>Br2>I2),下列反应的化学方程式或叙述不成立的是()A.Br2+2HI===I2+2HBrB.2FeCl2+Cl2===2FeCl3C.2FeCl2+2HCl+I2===2FeCl3+2HID.Cl2通入到NaBr和NaI的混合溶液中:Cl2优先氧化I-3.向NaCl、NaBr、NaI的混合溶液中通入足量的氯气后,把混合液蒸干,再将剩余残渣灼烧,最后留下的物质是()A.NaCl、NaBr、NaIB.NaCl、NaBrC.NaCl、I2D.NaCl4.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以I-的形式存在,实验室里从海藻中提取碘的流程如下:――→――→――→――→――→―→某化学兴趣小组对上述流程②③的设计如下图所示:已知②中发生反应的化学方程式为Cl2+2KI===2KCl+I2。回答下列问题:(1)写出提取过程中,实验操作①③的名称:①________,③________。(2)四氯化碳是________色、密度比水________的液体。F试管下层液体的颜色为________色,上层液体中溶质的主要成分为________。(3)从F中得到固...