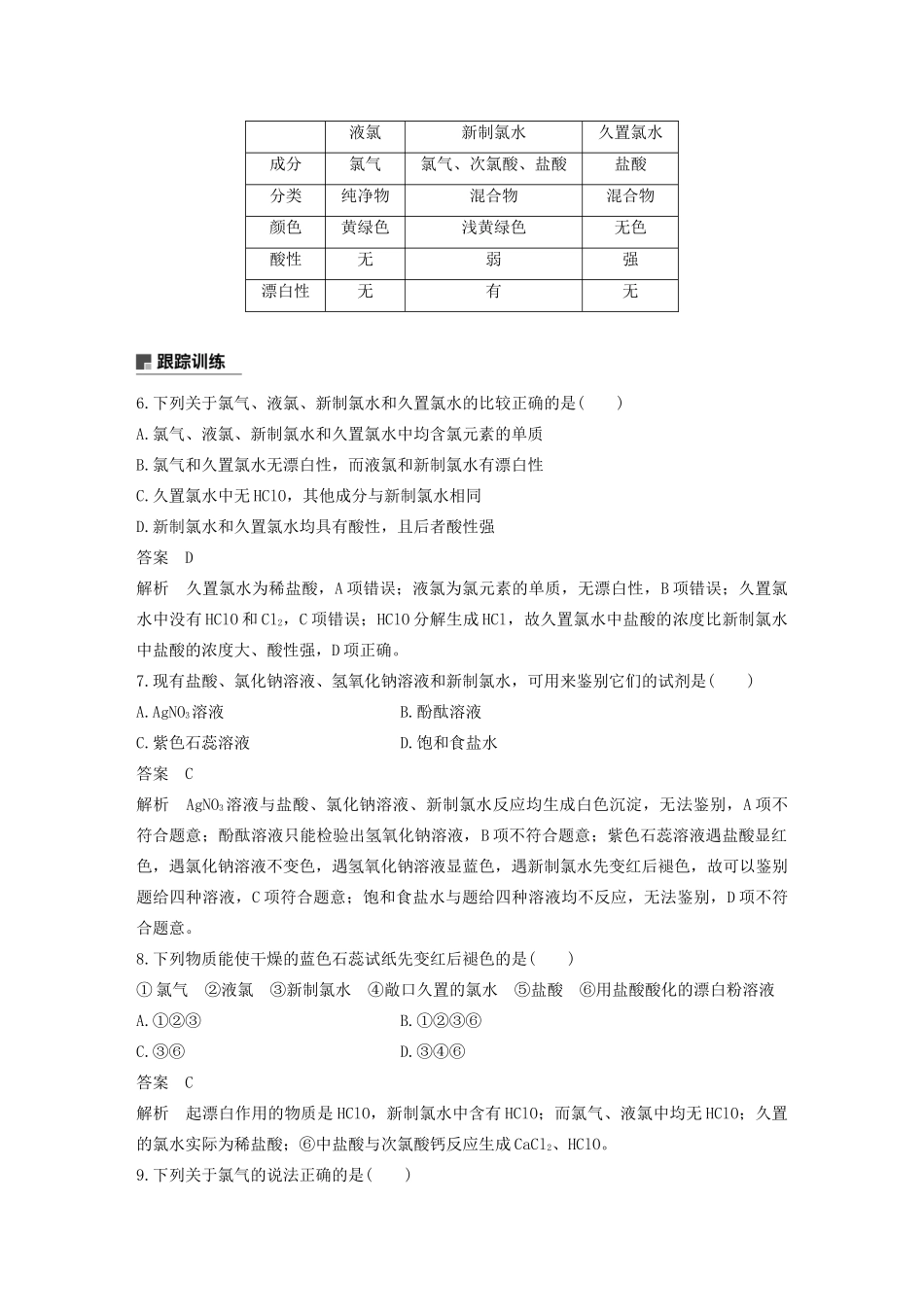
氯水的性质一、新制氯水的成分和性质1.氯水中的反应(1)氯气与水反应:Cl2+H2O===HCl+HClO;(2)光照条件下:2HClO=====2HCl+O2↑。2.氯水的成分新制氯水中含有盐酸、次氯酸和氯气。3.氯水的性质在不同的反应中,新制氯水起作用的成分不同。(1)表现氯气的性质,如氯水中通入硫化氢气体的反应为Cl2+H2S===S↓+2HCl。(2)表现次氯酸的性质,如在强光照射下新制氯水中有气泡产生;新制氯水能使有色布条褪色。(3)表现盐酸的性质,如氯水中加入活泼金属(镁等)、碳酸盐(CaCO3等)分别产生氢气和二氧化碳;氯水中加入硝酸银溶液产生氯化银白色沉淀。1.(2018·苏州高一检测)用自来水(以氯气为杀菌消毒剂)配制下列物质的水溶液,不会出现明显的药品变质问题的是()A.Na2CO3B.AgNO3C.CuSO4D.NaOH答案C解析Cl2与H2O反应产生HCl和HClO,则配制Na2CO3、AgNO3、NaOH时均会与HCl反应而变质,只有CuSO4不会变质。2.用玻璃棒蘸取新制氯水滴在蓝色石蕊试纸中部,观察到的现象是()答案B解析氯水中的H+能使蓝色石蕊试纸变红,氯水中的HClO具有漂白性,能使蓝色石蕊试纸褪色,故中间部分变为白色,四周仍有一圈红色。3.下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是()A.铁片加入新制氯水中,有无色气泡产生(H+)B.新制氯水使红色布条褪色(HCl)C.向新制氯水中滴加石蕊溶液,溶液先变红后褪色(H+、HClO)D.滴加AgNO3溶液有白色沉淀产生(Cl-)答案B解析新制氯水中含有三种分子:Cl2、H2O、HClO;四种离子:H+、Cl-、ClO-、OH-(极少量)。由于新制氯水中存在HCl,可发生反应:Fe+2HCl===FeCl2+H2↑,表现出酸性,即H+的性质,A项正确;新制氯水使红色布条褪色是因为次氯酸具有漂白性,B项错误;新制氯水中有H+,使紫色石蕊溶液变红,次氯酸具有漂白性,使变红的溶液又褪色,C项正确;新制氯水与AgNO3溶液发生反应:HCl+AgNO3===AgCl↓+HNO3,表现出Cl-的性质,D项正确。4.将紫色石蕊溶液滴入NaOH溶液中,溶液变蓝色,再通入氯气,溶液由蓝色先变成红色,最后颜色慢慢褪去,其原因是()①氯气有漂白性②氯气与NaOH溶液反应③氯气的水溶液呈酸性④次氯酸有漂白性⑤氯化钠有漂白性A.①④B.②③④C.①②③D.④⑤答案B解析氯气溶于氢氧化钠溶液会反应生成氯化钠、次氯酸钠和水。当氯气过量时,就会形成氯水。新制氯水中含有H+、HClO,具有酸性,所以使溶液由蓝色先变成红色;HClO具有漂白性,可使溶液的红色慢慢褪去,故选B。5.为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:(1)观察氯水颜色,发现氯水呈黄绿色,证明氯水中含有的粒子是________。(2)向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中含有的粒子是________。(3)在盛有氯水的试管中的有色布条褪色,说明氯水中含有的粒子是________。(4)将紫色石蕊溶液滴入新制氯水中,溶液显红色,起作用的微粒是________,过一会儿,溶液的颜色逐渐褪去,起作用的微粒是________。(5)向氯水中滴加AgNO3溶液有白色沉淀生成,证明氯水中含有的粒子是________。(6)氯水经光照后,颜色逐渐消失,并放出的气体是________,溶液的酸性________(填“增强”“不变”或“减弱”)。答案(1)Cl2(2)H+(3)HClO(4)H+HClO(5)Cl-(6)O2增强解析(1)氯水中含有的微粒有Cl2、HClO、H2O、H+、Cl-、ClO-和OH-(极少量),含有Cl2,使溶液呈现黄绿色。(2)滴入Na2CO3溶液有气体生成,证明溶液呈酸性,含H+。(3)氯水能使有色布条褪色,说明具有漂白性,证明氯水中含有HClO。(4)紫色石蕊溶液滴入新制氯水中,溶液呈红色,说明有H+存在,很快褪色,则是因为HClO起漂白作用。(5)向氯水中滴加AgNO3溶液有白色沉淀生成,证明氯水中有Cl-。(6)HClO不稳定,见光易分解放出O2,并生成盐酸,由于HClO为弱酸,而盐酸是强酸,故溶液酸性增强。二、液氯、新制氯水与久置氯水比较液氯新制氯水久置氯水成分氯气氯气、次氯酸、盐酸盐酸分类纯净物混合物混合物颜色黄绿色浅黄绿色无色酸性无弱强漂白性无有无6.下列关于氯气、液氯、新制氯水和久置氯水的比较正确的是()A.氯气、液氯、新制氯水和久置氯水中均含氯元素的单质B.氯气和久置氯水无漂...