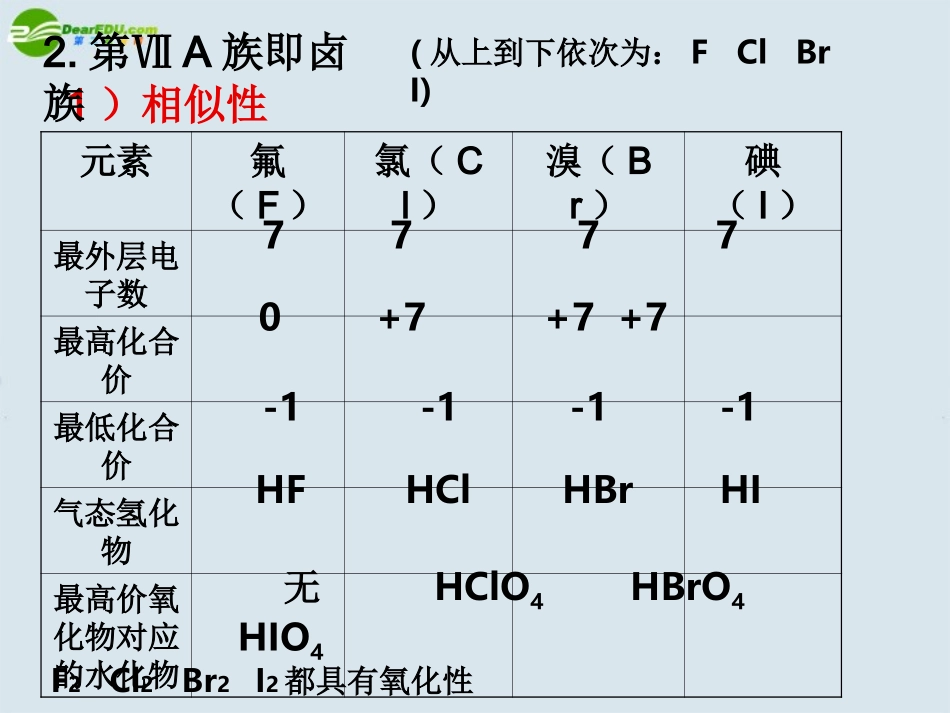
鲁科版普通高中课程标准实验教科书化学2(必修)第一章第三节元素周期表的应用(第二课时)交流研讨1、在元素周期表中,同主族元素原子的核外电子排布有什么特点?它对元素的性质有何影响?从上到下,随着原子核外电子层数增多,原子半径增大,原子核对最外层电子的吸引力减小,元素原子失电子能力增强,得电子的能力减弱。最外层电子数相同,化学性质相似;从上到下,电子层数逐渐增多二、预测同主族元素的性质1)相似性元素氟(F)氯(Cl)溴(Br)碘(I)最外层电子数最高化合价最低化合价气态氢化物最高价氧化物对应的水化物77770+7+7+7-1-1-1-1HFHClHBrHI无HClO4HBrO4HIO42.第ⅦA族即卤族(从上到下依次为:FClBrI)F2Cl2Br2I2都具有氧化性2)递变性(从上到下:a.电子层数逐渐增多,原子半径逐渐增大b.卤族元素单质与氢气化合由____到____F2Cl2Br2I2反应条件反应程度氢化物的稳定性暗处光照或点燃200度加热不断高温加热爆炸剧烈缓慢缓慢很稳定稳定较不稳定很不稳定易难c.气态氢化物的稳定性:HF>HCl>HBr>HId.得电子能力:F>Cl>Br>Ie.酸性:HClO4>HBrO4>HIO4FClBrI)3.第ⅠA族(LiNaKRbCs称为碱金属元素)1)碱金属元素的相似性a.最外层电子数为1b.最高化合价:+1C.易失电子,最高价氧化物对应的水化物碱性强2)递变性从上到下:a.电子层数逐渐增多,原子半径逐渐增大内容现象结论K与水反应Na与水反应b.与水反应置换出氢的能力_______浮在水面上,四处游动,熔成闪亮的火球,发出紫色的火焰,伴有轻微的爆炸现象浮、球、游、声2K+2H2O=2KOH+H2↑2Na+2H2O=2NaOH+H2↑逐渐增强c.失电子能力:d.最高价氧化物对应的水化物碱性_________逐渐增强LiNaKRbCsLi