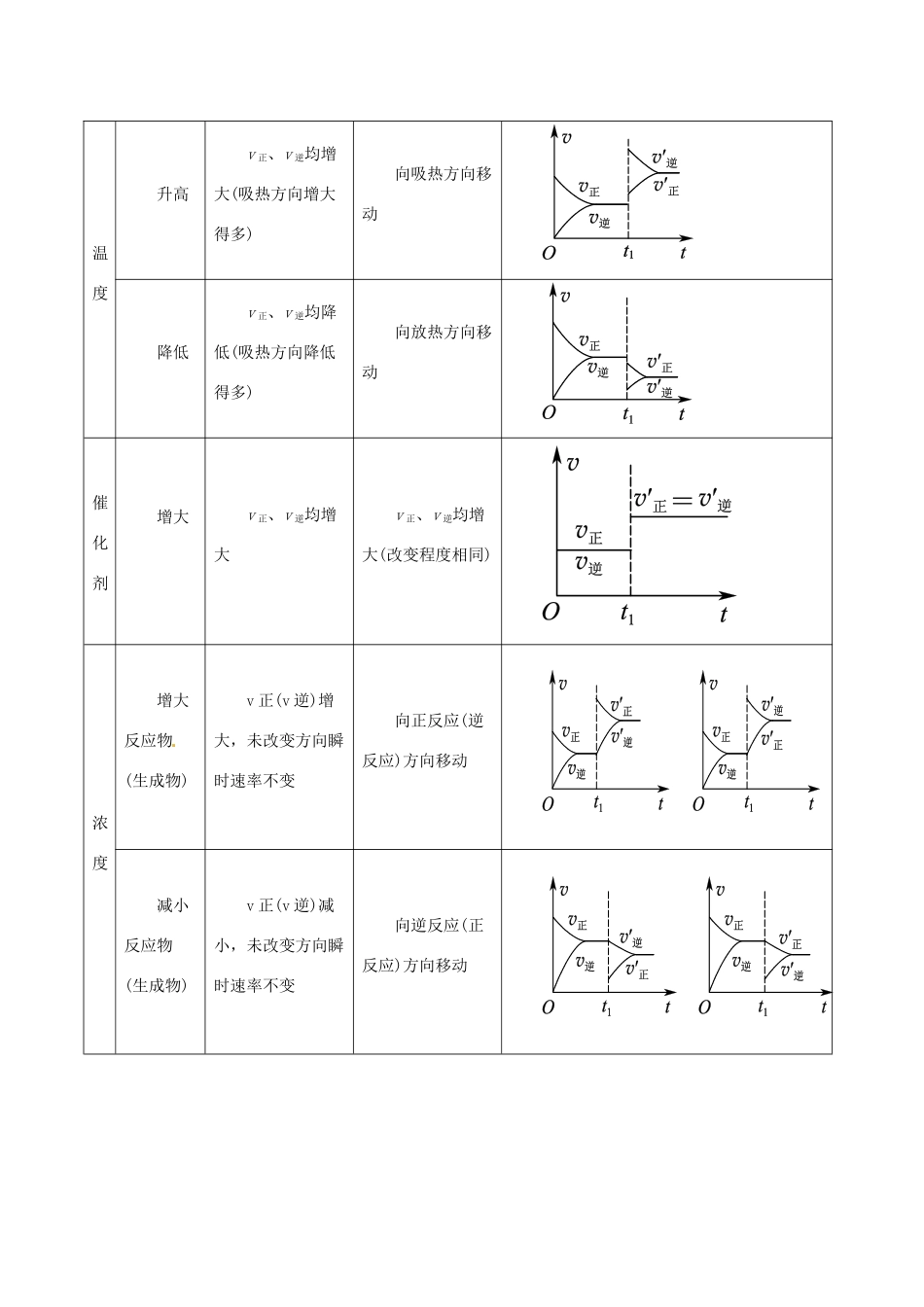
专题16化学反应速率和化学平衡综合热点题型和提分秘籍【高频考点解读】该部分知识在近年高考题中主要以非选择题形式呈现,主要考查对化学反应速率、化学平衡、化学平衡常数以及勒夏特列原理的理解与应用等;在非选择题中则往往以化学平衡常数为中心,考查化学反应速率、化学平衡的基本问题及有关计算,同时结合化学反应中的能量变化、电化学等知识点进行综合考查,强调学科内综合应用。【热点题型】题型一考查外界条件对化学反应速率、化学平衡的影响例1、一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)4NO2(g)+O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图73所示,下列说法正确的是()A.10min时,反应达到平衡B.达到平衡时N2O5的转化率为60%C.0~20min内平均反应速率v(N2O5)=0.05mol·L-1·min-1D.曲线a表示NO2的物质的量随反应时间的变化【提分秘籍】外界条件对化学反应速率、化学平衡的影响(只改变一个条件)改变条件速率变化平衡移动示例:N2(g)+3H2(g)2NH3(g)ΔH=-92.4kJ·mol-1温度升高v正、v逆均增大(吸热方向增大得多)向吸热方向移动降低v正、v逆均降低(吸热方向降低得多)向放热方向移动催化剂增大v正、v逆均增大v正、v逆均增大(改变程度相同)浓度增大反应物(生成物)v正(v逆)增大,未改变方向瞬时速率不变向正反应(逆反应)方向移动减小反应物(生成物)v正(v逆)减小,未改变方向瞬时速率不变向逆反应(正反应)方向移动压强增大v正、v逆均增大(体积减小方向增大得多)向体积减小方向移动减小v正、v逆均减小(体积增大方向减小得多)向体积增大方向移动【特别提醒】特殊情况下改变外界条件对化学反应速率和化学平衡的影响:(1)固体、纯液体无浓度变化,增加其量对反应速率及平衡均无影响。(2)等体积反应改变压强同方向、同等程度的改变正、逆反应速率,只改变到达平衡所需的时间,不影响化学平衡。【举一反三】1.[·山东卷]对于反应CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0,在其他条件不变的情况下()A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变B.改变压强,平衡不发生移动,反应放出的热量不变C.升高温度,反应速率加快,反应放出的热量不变D.若在原电池中进行,反应放出的热量不变【热点题型】题型二考查化学平衡状态的判断和化学平衡常数例2、据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)。某科研小组将2molCO2与4molH2通入一体积不变的密闭容器甲进行上述反应,下列叙述正确的是()A.当v(CO2)正=2v(CH3CH2OH)正时,反应一定达到平衡状态B.当平衡向正反应方向移动时,平衡常数一定增大C.当CO2和H2的物质的量比不变时,说明反应已达平衡状态D.当容器中混合气体的密度不变时,反应已达平衡状态【误区警示】在利用正逆反应速率相等判断化学平衡状态时,要特别注意选项中是否指的是用同一种物质表示的正、逆两个反应方向的反应速率相等。【提分秘籍】化学平衡状态的判断和化学平衡常数1.化学平衡的标志(反应前后体积有变化)(1)直接标志①正、逆反应速率相等;②各组分的量保持不变(如各组分的物质的量、浓度、百分含量、体积分数等)。(2)间接标志①反应体系物质的总量如压强、物质的量、平均相对分子质量、密度、体积不变;②其他标志:如有色气体参加或生成的反应体系的颜色不变等。2.化学平衡常数应用中的注意事项(1)化学平衡常数是指某一具体反应的平衡常数,化学方程式计量数变化,化学平衡常数也变化;(2)化学平衡常数只与温度有关,与反应物、生成物浓度无关。化学平衡常数表达式中各物质的浓度“为平衡浓度。固体或纯液体不出现在平衡常数的表达式中,按1”对待;(3)升高温度K增大,则正反应为吸热反应;升高温度K值减小,则正反应为放热反应;(4)化学平衡常数K越大,反应限度越大,反应物转化率越大;(5)K应用于判断平衡移动的方向:当Qc<K,反应向正反应方向进行;Qc=K,反应处于平衡状态;Qc>K,反应向逆反应方向进行。【举一反三】一定温度下,向某恒容的密闭容器中加入0.2molCO和0.2molH2O,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g...