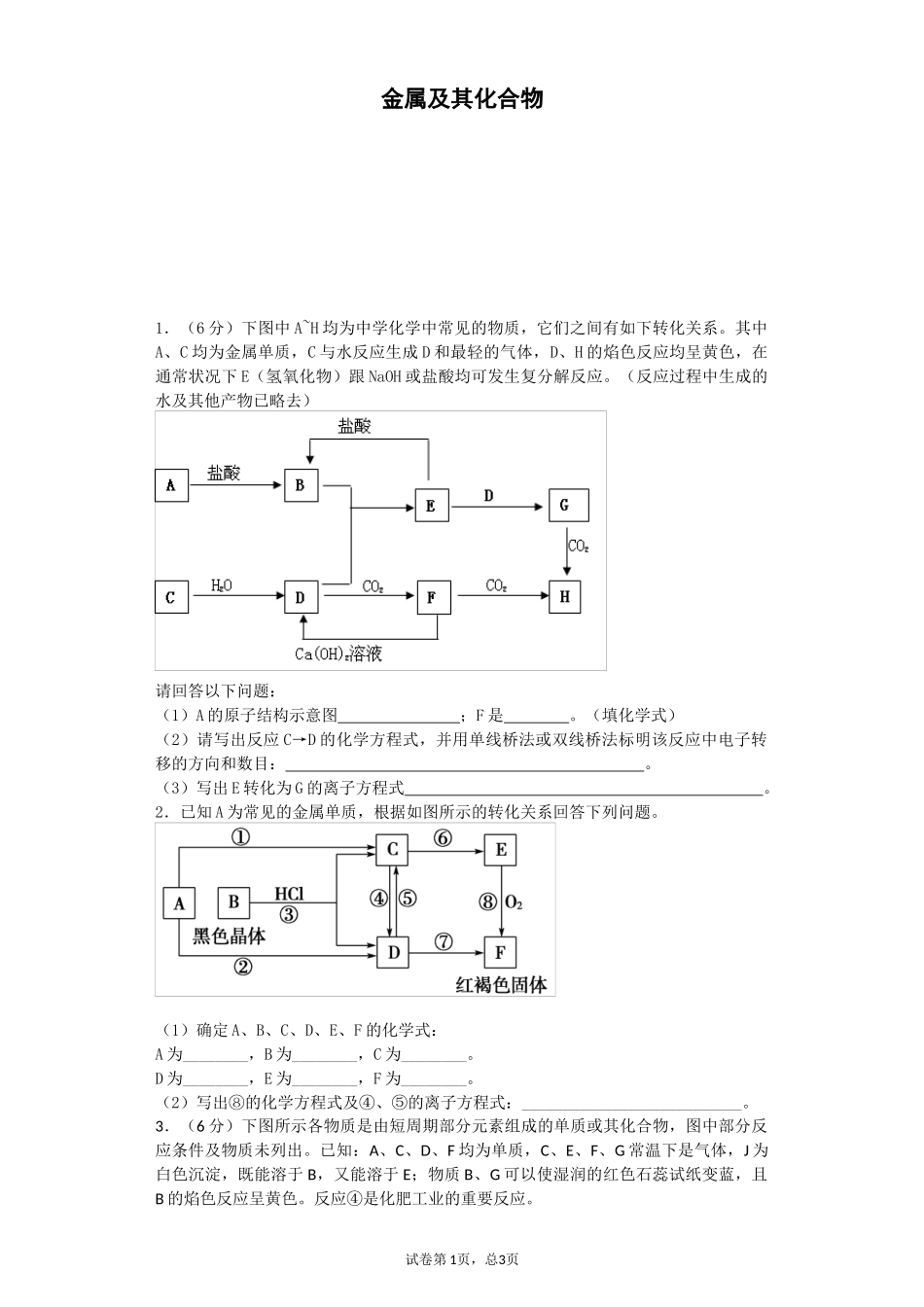
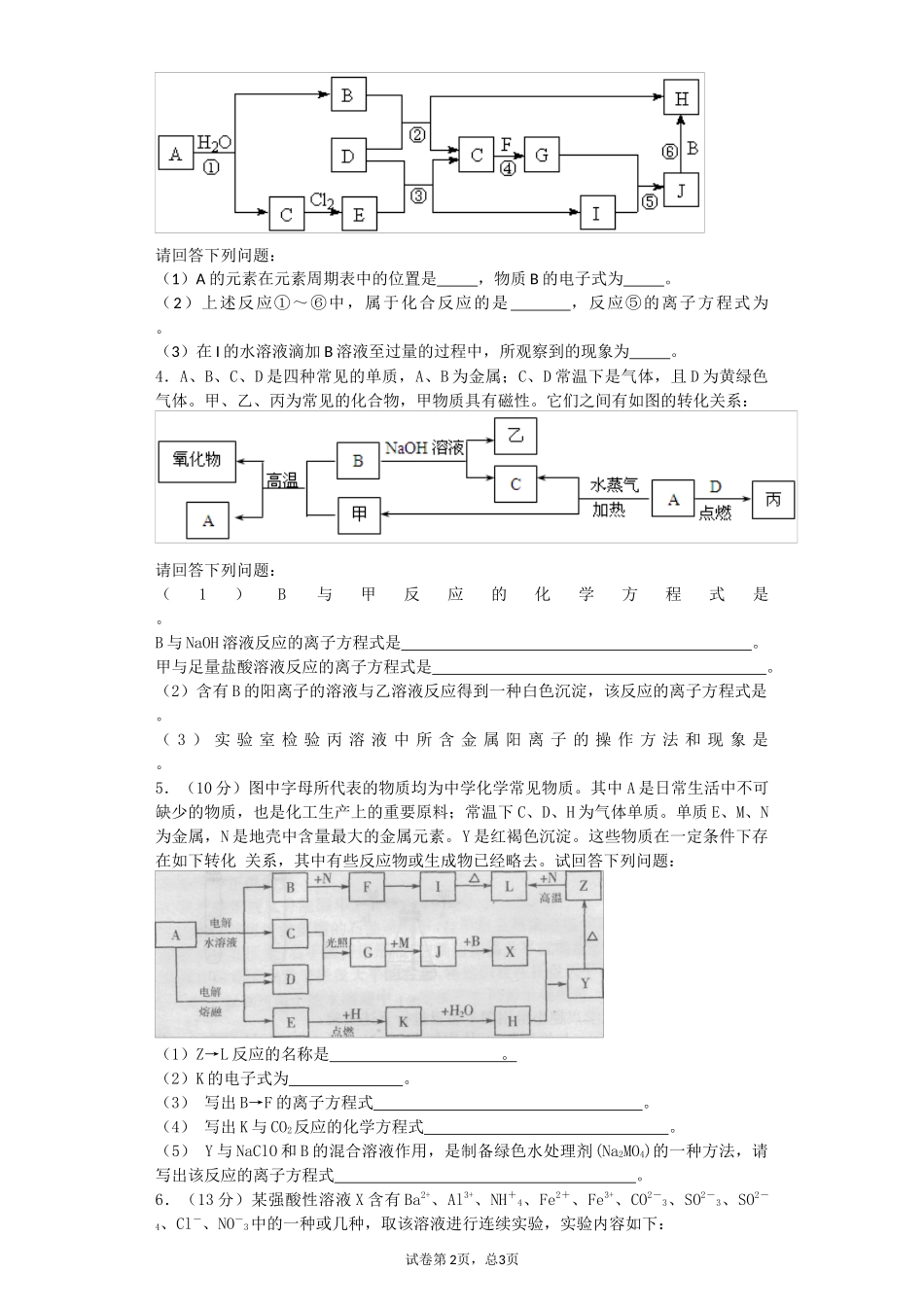
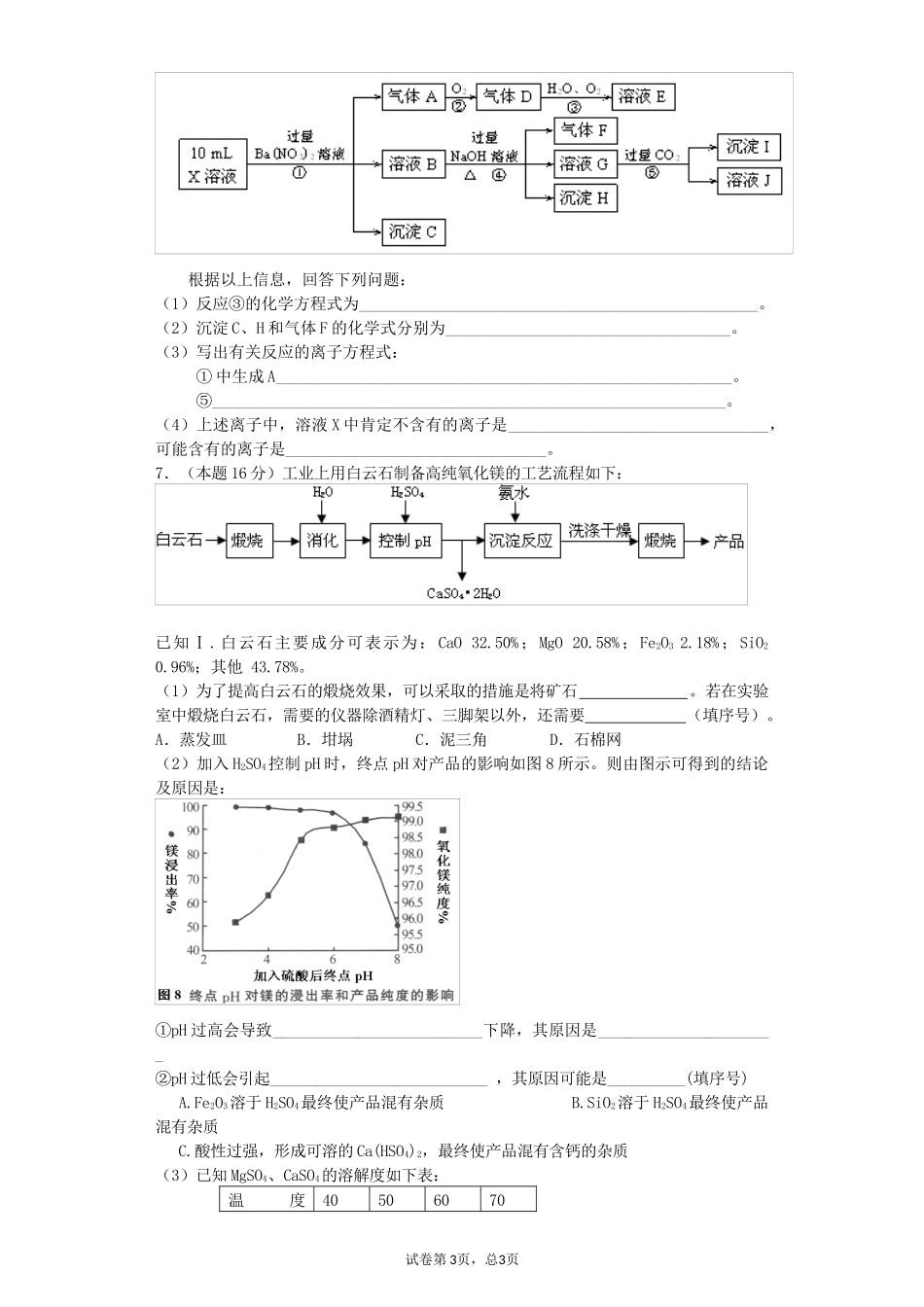
金属及其化合物1.(6分)下图中A~H均为中学化学中常见的物质,它们之间有如下转化关系。其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应。(反应过程中生成的水及其他产物已略去)请回答以下问题:(1)A的原子结构示意图;F是。(填化学式)(2)请写出反应C→D的化学方程式,并用单线桥法或双线桥法标明该反应中电子转移的方向和数目:。(3)写出E转化为G的离子方程式。2.已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。(1)确定A、B、C、D、E、F的化学式:A为________,B为________,C为________。D为________,E为________,F为________。(2)写出⑧的化学方程式及④、⑤的离子方程式:___________________________。3.(6分)下图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质未列出。已知:A、C、D、F均为单质,C、E、F、G常温下是气体,J为白色沉淀,既能溶于B,又能溶于E;物质B、G可以使湿润的红色石蕊试纸变蓝,且B的焰色反应呈黄色。反应④是化肥工业的重要反应。试卷第1页,总3页请回答下列问题:(1)A的元素在元素周期表中的位置是,物质B的电子式为。(2)上述反应①~⑥中,属于化合反应的是,反应⑤的离子方程式为。(3)在I的水溶液滴加B溶液至过量的过程中,所观察到的现象为。4.A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲物质具有磁性。它们之间有如图的转化关系:请回答下列问题:(1)B与甲反应的化学方程式是。B与NaOH溶液反应的离子方程式是。甲与足量盐酸溶液反应的离子方程式是。(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是。(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是。5.(10分)图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。试回答下列问题:(1)Z→L反应的名称是。(2)K的电子式为。(3)写出B→F的离子方程式。(4)写出K与CO2反应的化学方程式。(5)Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出该反应的离子方程式。6.(13分)某强酸性溶液X含有Ba2+、Al3+、NH+4、Fe2+、Fe3+、CO2-3、SO2-3、SO2-4、Cl-、NO-3中的一种或几种,取该溶液进行连续实验,实验内容如下:试卷第2页,总3页根据以上信息,回答下列问题:(1)反应③的化学方程式为_________________________________________________。(2)沉淀C、H和气体F的化学式分别为___________________________________。(3)写出有关反应的离子方程式:①中生成A________________________________________________________。⑤_______________________________________________________________。(4)上述离子中,溶液X中肯定不含有的离子是________________________________,可能含有的离子是________________________________。7.(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下:已知Ⅰ.白云石主要成分可表示为:CaO32.50%;MgO20.58%;Fe2O32.18%;SiO20.96%;其他43.78%。(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要(填序号)。A.蒸发皿B.坩埚C.泥三角D.石棉网(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:①pH过高会导致___________________________下降,其原因是_______________________②pH过低会引起____________________________,其原因可能是__________(填序号)A.Fe2O3溶于H2SO4最终使产品混有杂质B.SiO2溶于H2SO4最终使产品混有杂质C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质(3...