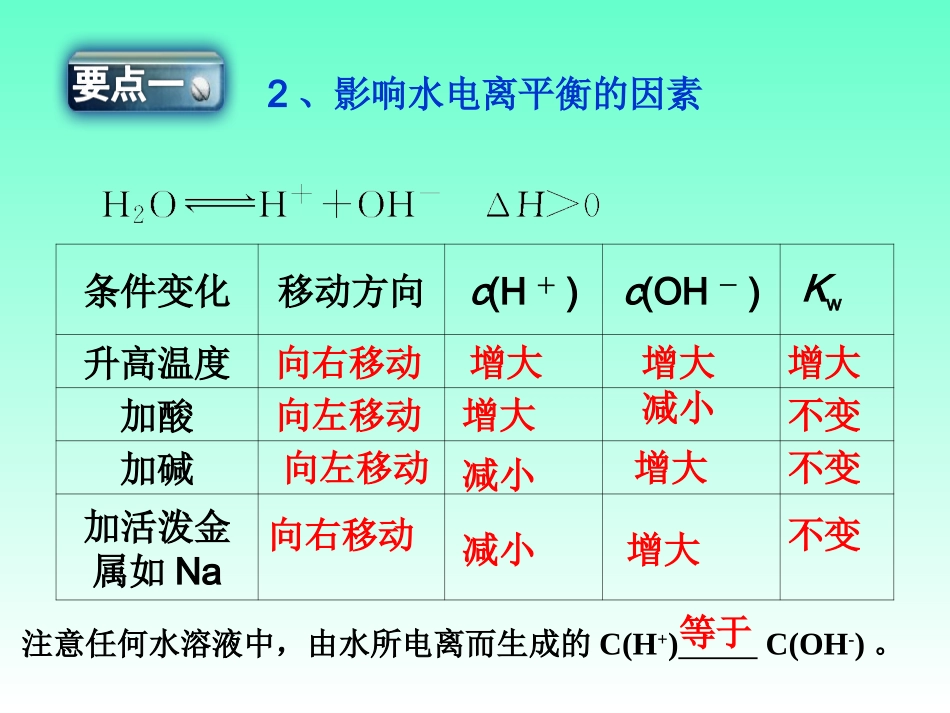
第二节水的电离和溶液的酸碱性水的电离溶液的酸碱性和pH1:水的电离.水是一种_____的电解质。能发生_____电离。其电离方程式为:___________________简写___________________。极弱10-7H2O+H2OH3O++OH-微弱一、水的电离10-725℃时实验测得,在室温下1LH2O(即mol)中只有1×10-7molH2O电离,常温下纯水中c(H+)=______mol/L,c(OH-)=______mol/L。55.62、影响水电离平衡的因素条件变化移动方向c(H+)c(OH-)Kw升高温度加酸加碱加活泼金属如Na向右移动增大增大增大向左移动增大减小不变向左移动减小增大不变向右移动减小增大不变注意任何水溶液中,由水所电离而生成的C(H+)C(OH-)。等于1.在某温度时,测得纯水中的c(H+)=2.0×10-7mol·L-1,则c(OH-)为()A.2.0×10-7mol·L-1B.0.1×10-7mol·L-1C.1.0×10-14mol·L-1D.无法确定A2.在25℃时,测得某酸溶液中由水电离出来的c(OH-)=1.0×10-10mol·L-1,则由水电离出来的c(OH-)c(H+)为()A.1.0×10-7mol·L-1B.1.0×10-10mol·L-1C.1.0×10-20mol2·L-2D.无法确定[反馈练习]:Cc(H+)·c(OH-)3.水的离子积常数(1)水的电离平衡常数:K电离=_________________________。c(H2O)c(H+)·c(OH-)K电离c(H2O)(2)水的离子积常数水的离子积Kw=_______________=__________(1)Kw与化学平衡常数一样,其变化只受______的影响。在25℃时,c(H+)=c(OH-)=______mol/L,故此温度下Kw=______。升温,Kw______(填“增大”、“减小”或“不变”),降温,Kw将______(填“增大”、“减小”或“不变”)。温度10-710-14增大10-12减小(2)KW不仅适用于纯水,也适用于酸、碱、盐的稀溶液。即酸、碱、盐的稀溶液中Kw=______如100℃的纯水中:c(H+)=1×10-6mol/L,Kw=______,4、影响水的离子积常数的因素c(H+)·c(OH-)思考感悟1,水的离子积Kw=c(H+)·c(OH-)公式中Kw就是电离常数,c(H+)和c(OH-)就是水电离出的c(H+)和c(OH-),正确吗?2,25℃水电离出的c(H+)有可能小于10-7mol/L吗?若有,则此时说明了什么问题?【提示】(1)都不正确。据Kw=K电离·c(H2O)知,Kw和电离常数K不是同一个物理量,而c(H+)和c(OH-)是整个溶液中的c(H+)和c(OH-),不一定都是由水电离出来的。(2)酸和碱抑制H2O的电离,使H2O电离出的c(H+)水=c(OH-)水<10-7mol/L,所以,当信息中给出c(H+)水=c(OH-)水<10-7mol/L时,则说明H2O的电离被抑制,可能是加入了酸或碱。练习3:25℃时的下列溶液①在0.01mol/LHCl溶液中的,Kw=______C(H+)=,C(OH-)=,由水电离出的OH-浓度=,由水电离出的H+浓度=。②在0.01mol/LNaOH溶液中的,Kw=______C(OH-)=C(H+)=,由水电离出的H+浓度=,由水电离出的OH-浓度=。③在0.01mol/LNaCl溶液中的,Kw=______C(OH-)=,C(H+)=,由水电离出的H+浓度=,由水电离出的OH-浓度=。10-1210-210-1210-1210-1210-210-710-710-710-710-1210-1210-1410-1410-14二、溶液的酸碱性1.溶液的酸碱性与c(H+)和c(OH-)的关系溶液的酸碱性取决于c(H+)和c(OH-)的________________。酸性溶液:c(H+)___c(OH-);中性溶液:c(H+)___c(OH-);碱性溶液:c(H+)___c(OH-)。>=<大小问题酸性溶液中有无OH-,碱性溶液中有无H+,判断溶液酸碱性的标准是什么?