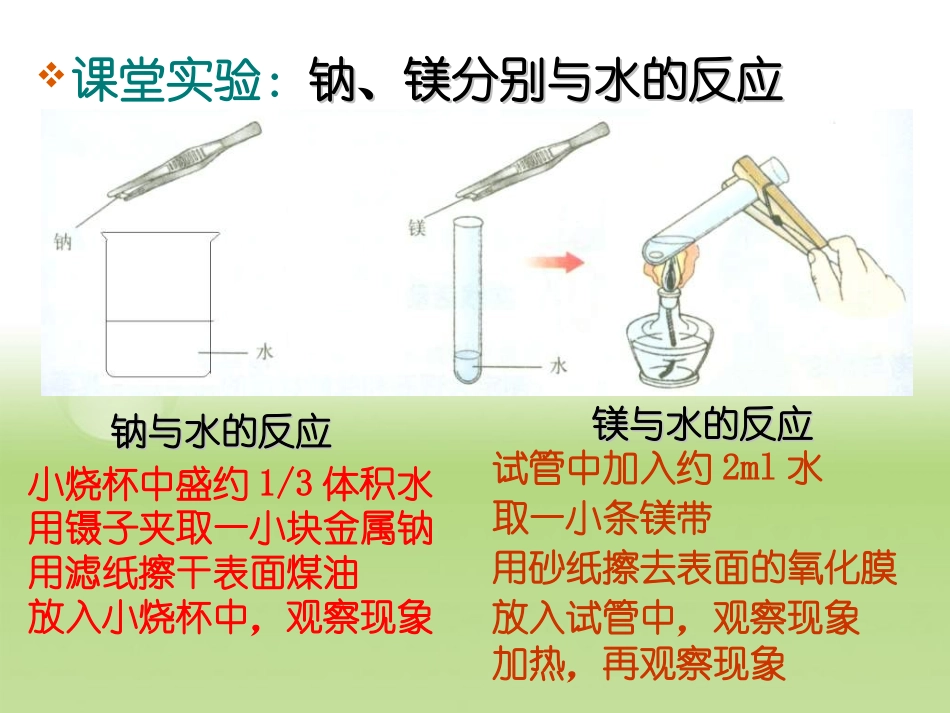
66揭示化学反应速率和平衡之谜揭示化学反应速率和平衡之谜66揭示化学反应速率和平衡之谜揭示化学反应速率和平衡之谜6.16.1为什么化学反应有快有慢为什么化学反应有快有慢一.化学反应有快有慢一个化学反应的快与慢究竟是由什么决定的?课堂实验:钠、镁分别与水的反应钠、镁分别与水的反应钠与水的反应钠与水的反应镁与水的反应镁与水的反应小烧杯中盛约1/3体积水用镊子夹取一小块金属钠用滤纸擦干表面煤油放入小烧杯中,观察现象试管中加入约2ml水取一小条镁带用砂纸擦去表面的氧化膜放入试管中,观察现象加热,再观察现象实验记录实验记录钠与水反应的现象钠与水反应的现象________________________________________________________________________________________________________________________________________镁与水反应的现象镁与水反应的现象____________________________________________________________________结论结论________________________________________________________________________________________________________________________金属钠熔成小球在水面上迅速游动,放出气体,很快就消失了。与冷水无现象,加热后有少量气泡产生①钠与水的反应比镁与水的反应快②加热可以加快化学反应速率决定化学反应快慢的因素①反应物本身的性质影响化学反应速率②改变外界条件可改变化学反应速率有碳酸钠溶液、碳酸钾溶液,分别与同浓度的盐酸反应。试比较两个反应的反应速率的快慢。试一试二.化学反应速率((一)化学反应速率的意义及表示方法一)化学反应速率的意义及表示方法1.1.化学反应速率化学反应速率是定量表示化学反应快慢的物理量是定量表示化学反应快慢的物理量2.2.表示方法表示方法通常用单位时间内指定反应物浓度的通常用单位时间内指定反应物浓度的减小减小或指或指定生成物浓度的定生成物浓度的增大增大来表示来表示3.3.计算公式计算公式υ==△△c/c/△△tt4.4.单位单位mol/(Lmol/(L..min)mol/(Lmin)mol/(L..s)mol/s)mol/(L(L..h)h)对公式的说明((11)化学反应速率不取负值,)化学反应速率不取负值,v>0v>0((22))一般计算出来的化学反应速率是一一般计算出来的化学反应速率是一段时间内的平均速率,不是瞬时速率。段时间内的平均速率,不是瞬时速率。((33)固体、纯液体不能用浓度的变化来)固体、纯液体不能用浓度的变化来表示化学反应速率。表示化学反应速率。阅读教材阅读教材P37P37思考与练习思考与练习要求:要求:1.1.根据表中数据计算,分别以氢气浓度的减少、氨气根据表中数据计算,分别以氢气浓度的减少、氨气浓度的增加来表示该化学反应的速率浓度的增加来表示该化学反应的速率((υ==△△c/c/△△t)t)思考与练习思考与练习2.用不同物质表示该反应的反应速率,数值之间有什么关系?为什么?结论结论(在同一条件下)(在同一条件下)((11)同一反应,可选用不同的物质来表)同一反应,可选用不同的物质来表示化学反应速率,其数值示化学反应速率,其数值不一定不一定相等,相等,但意义相同。但意义相同。((22)同一反应中,各物质的化学反应)同一反应中,各物质的化学反应速速率率之比等该化学方程式中的之比等该化学方程式中的系数系数之比。之比。练习在体积为2L的密闭容器中充入2mol的氮气与8mol氢气,一定条件下发生反应。5min后,测得容器内还有5mol氢气。试计算用NH3的浓度变化表示的反应速率。练习合成氨反应为:N2+3H22NH3,其反应速率可以分别用υ(H2)、υ(N2)、υ(NH3)来表示,则正确的关系是()A.υ(H2)=υ(N2)=υ(NH3)B.υ(H2)=2υ(NH3)C.2υ(NH3)=3υ(H2)D.υ(H2)=3υ(N2)D练习练习对于反A2+3B22AB3以下表示的反应速率中,速率最大的是()A、υ(A2)=0.4mol·(L-1·min-1)B、υ(B2)=0.8mol·(L-1·min-1)C、υ(AB3)=0.6mol·(L-1·min-1)D、υ(A2)=0.01mol·(L-1·S-1)D(二)化学反应速率的测定方法1.选择一个合适的反应:①要有明显的现象②要有易于测定的变化量2.选择适宜的反应条件,如、浓度、温度等根据计算公式计算公式υ==△△c/c/△△tt,讨论测定方法...