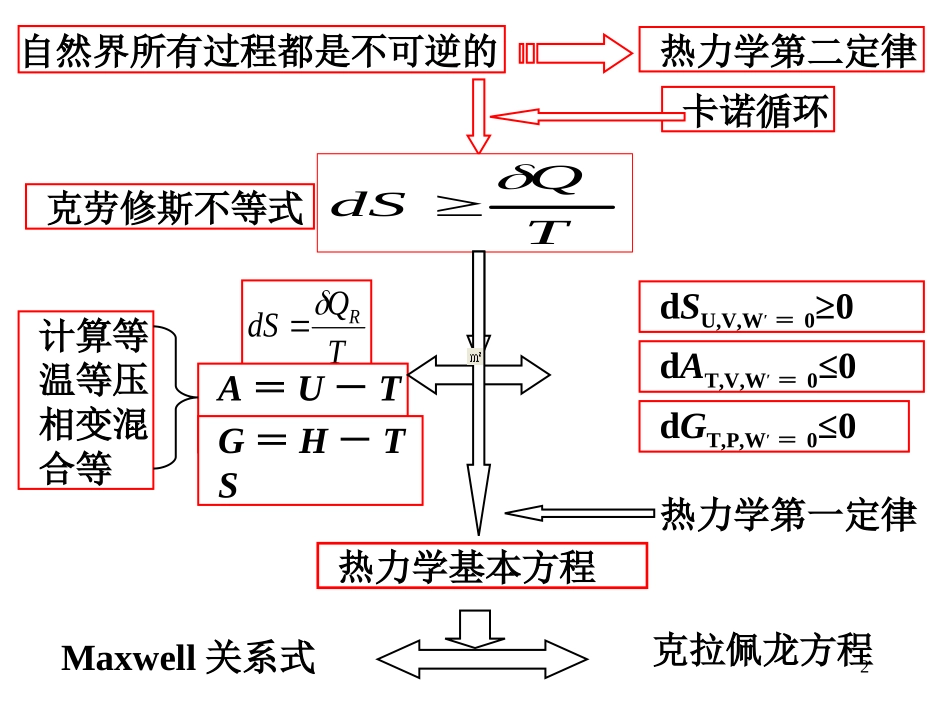
1热力学第二定律习题课2TQdSRA=U-TSG=H-TS自然界所有过程都是不可逆的热力学第二定律Maxwell关系式克拉佩龙方程dSU,V,W′=0≥0dAT,V,W′=0≤0dGT,P,W′=0≤0卡诺循环热力学第一定律计算等温等压相变混合等TQdS克劳修斯不等式热力学基本方程3第三章化学热力学基础(二)一、热力学第二定律的文字表述克劳修斯:不可能把热由低温物体转移到高温物体,而不留下其他变化。开尔文:不可能从单一热源吸热使之完全变为功,而不留下其他变化。实质:自然界中一切实际进行的过程都是不可逆的。封闭系统:可逆不可逆或可逆不可逆suBAsuδdδTQSTQS≥≥二、克劳修斯不等式(热力学第二定律的数学表达)4三、熵、亥姆霍茨函数和吉布斯函数的定义S——熵是状态函数,广度性质,SI单位J·K-1A=U-TS△AT=△U-T△SG=H-TS△GT=△H-T△SA、G——状态函数,广度性质,SI单位JBATQSTQSRR,d5四、平衡判据可逆不可逆或可逆不可逆孤立绝热0d0≥≥SS当绝热体系或孤立体系中由某一状态到达另一状态时,它的熵不减少。熵增原理(1)隔离体系(2)()T,V,W′=0(3)()T,P,W′=0dAT,V,W’=0≤0dGT,P,W’=0≤0在定温、恒压且W′=0时,只能自发地向G减小的方向进行,直到ΔGT,V=0时,系统达到平衡。在定温、恒容且W′=0时,只能自发地向A减小的方向进行,直到ΔAT,V=0时,系统达到平衡。6五、体系△S、△A、△G的计算(主要是△S)BARTQS1、单纯p,V,T变化过程的计算(1)()p21dδm,TTpppTTnCTQS若Cp,m视为常数,则12m,lnTTnCSpp(2)()V21dδm,TTVVVTTnCTQS若Cv,m视为常数,则12m,lnTTnCSVV7(3)()TBARTQS=nRlnV2/V1=nRlnp1/p2(i.g)(4)()T,P,mixmixS=-∑nBRlnyB对于理想气体的p,V,T任意变化始态(T1,V1)终态(T2,V2)(T1,V2)S定温定容STSVS=ST+SV=+12lnVVnR12m,lnTTnCV82、相变化过程的计算(1)在平衡温度,压力下的相变(可逆相变)(2)非平衡温度,压力下的相变(不可逆相变)S需寻求可逆途径进行计算。△A=△U-T△S=W=-nRTl(s)→g=0凝聚体系△GT,P,W′=0=0THnSm9不可逆相变B(,T1,p1)B(,Teq,peq)B(,T2,p2)B(,Teq,peq)S=?可逆相变S2S1S3则:S=S1+S2+S33、化学变化过程的计算(1)热力学第三定律:S*(完美晶体,0K)=0Sm(B,相态,T)—标准摩尔熵[标准态下(p=100kPa)的规定摩尔熵]。10(2)化学反应熵变的计算298.15K:rSm(T)=ΣνBSm(B,相态,T)△rGm(T)=△rHm(T)-TrSm(T)△rHm=已经在介绍热力学第一定律中介绍六、熵的物理意义熵是系统内部物质分子的混乱度的量度。系统混乱度愈大,其熵值愈高。温度为T时:T298.15Kmp,Bmrmr(B)dC.15K)298(S(T)STT11七、热力学基本方程式pdVTdSdUVdpTdSdHpdVSdTdAVdpSdTdG八、麦克斯韦关系式PSSVPT)()(VSSPVT)()(PSTPVS)()(PTTVPS)()(①②③④(-)PTVS(-)HUpVpVATSTSG适用条件是:(i)封闭系统;(ii)组成一定;(iii)无非体积功12(1)克拉佩龙方程mmddVTHTp(2)克劳修斯---克拉佩龙方程CRTHpmvap}ln{九、纯物质的两相平衡2mvapddlnRTHTp12mvap1211lnTTRHppln{p}ln{p}—1/TK示意图1/TK13一、概念题1.在高温热源T1和低温热源T2之间的卡诺循环,其热温熵之和Q1/T1+Q2/T2=().循环过程的热机效率=()。2.任一不可逆循环的热温商的总和,可表示为()03.式Q=-W=TS=-G=-A=nRTln(V2/V1)=nRTln(p1/p2)适用的条件()。4.G=A适用的条件()。5.状态方程为(p+a/Vm2)Vm=RT的气体,恒温过程的Sm=().不可逆)/(TQ6.卡诺热机中的工作介质可以是理想气体,也可以是实际气体,还可以是水等物质。(对,错)147.试写出克劳修斯不等式。8.从一个热源吸热使之完全转化为功,而不发生其他变化是不可能的。(对,错)9.△G=△H-T△S的适用条件是。10.下列过程中△U、△H、△S、△A、△G何者为零?(1)理想气体自由膨胀过程(2)H2(g)和Cl(g)在绝热的刚性容...