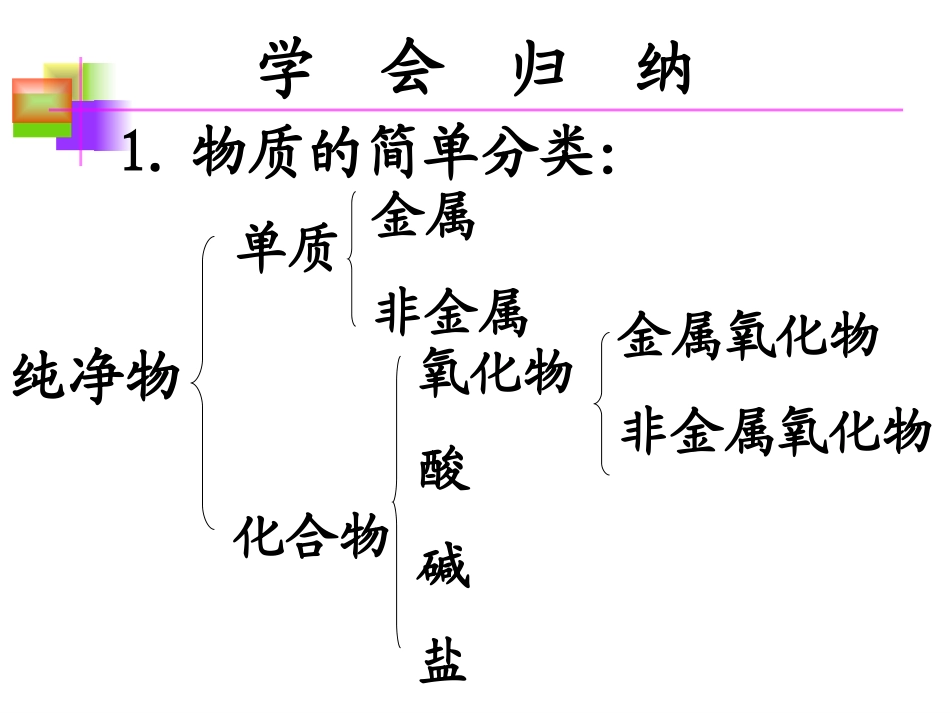
九年级化学九年级化学复习重点一.酸、碱、盐的组成、分类和命名二.单质、氧化物、酸、碱、盐的相互关系单质化合物金属非金属氧化物酸碱盐金属氧化物非金属氧化物纯净物学会归纳1.物质的简单分类:2.本章常见化合物:氧化物:酸:碱:盐:CO2、SO2、CuO、Fe2O3HCl、H2SO4、HNO3NaOH、Ca(OH)2、NH3H•2ONa2CO3、NaCl、CuSO4NaHCO3CaCO3Cu:CuO:Fe:Fe2O3:Cu(OH)2:Fe(OH)3:CuSO4固体:CuSO4溶液:FeCl2溶液:FeCl3溶液:红色黑色银白色红棕色蓝色红褐色白色蓝色浅绿色黄色学会比较1物质颜色:1.CaOCa(OH)22.NaOHNa2CO33.FeCl3FeCl24.Fe(OH)3Fe(OH)25.FeOFe2O3Fe3O46.NH3NH4+生石灰熟石灰烧碱、火碱、苛性钠纯碱、苏打氯化铁氯化亚铁氢氧化铁氢氧化亚铁氧化亚铁氧化铁四氧化三铁氨气铵根离子学会比较2物质名称写出下列物质的化学式,并指出它们各属于哪一类化合物:硝酸氯化亚铁熟石灰硫酸硫酸铁氧化铁纯碱烧碱氯化银硝酸钡HNO3FeCl2Ca(OH)2H2SO4Fe2(SO4)3Fe2O3Na2CO3NaOHAgClBa(NO3)2氧化物盐碱盐盐酸盐碱酸盐学以致用4、酸+碱→盐+水3、酸+金属氧化物→→盐+水5、酸+(某些)盐→新酸+新盐1、酸与指示剂作用:使紫色石蕊试液变红,使无色酚酞试液不变色酸2、酸+活泼金属→盐+H2新盐新盐++新碱新碱←←盐盐++碱碱++非金属氧化物非金属氧化物→→盐盐++水水++酸酸→→盐盐++水水使紫色石蕊试液变蓝使无色酚酞试液变红碱溶液与指示剂作用碱+金属→新金属+新盐两种新盐←盐+新碱新碱++新盐新盐←碱碱+++酸→新酸+新盐盐使石蕊变红,酚酞无色金属氧化物活泼金属使石蕊变蓝酚酞变红非金属氧化物金属盐二.单质、氧化物、酸、碱、盐的相互关系酸碱盐判断下列物质能否发生化学反应,能反应的写出化学方程式,不能反应的说明理由:1铁和稀硫酸2银和稀盐酸3铁和硫酸铜溶液4铜和氯化银5镁和硝酸锌溶液6氢氧化钠溶液和氯化铁溶液7碳酸钙和稀盐酸8硫酸锌溶液和硝酸钠溶液9碳酸钡和硫酸钠溶液10碳酸钠溶液和氯化钙溶液练一练1.金属跟酸、金属跟盐是否能发生反应,要根据金属活动性顺序加以判断。2.铁跟盐酸、稀硫酸等起置换反应,生成亚铁盐。3.金属跟硝酸起反应时,由于硝酸的氧化性很强,一般不生成氢气。且即使活动性排在氢后面的金属,也能和硝酸发生氧化还原反应。学会归纳14.钠、钾等化学性质极为活泼的金属,跟盐溶液反应的情况比较复杂,例如钠跟硫酸铜溶液反应:2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Na2SO4+Cu(OH)2↓1.复分解反应能不能发生,要考虑生成物中是否有沉淀、气体或水生成。2.盐跟碱、盐跟盐反应时,反应物必须是可溶的。学会归纳21.金属活动顺序表.KCaNaMgAlZnFeSnPbHCuHgAgPtAu2.酸碱盐溶解性表(1)钾钠铵盐硝酸盐都能溶于水中间,盐酸难溶银亚汞,硫酸难溶是钡铅,碳酸多为不溶盐,溶者只有钾钠铵。(2)难溶碱:氢氧镁、铝、锌、铁、铜。两个“表”3、生成盐和水反应类型(共3种)、、。4、过量Fe投入AgNO3、Cu(NO3)2溶液中,得到固体;Fe、Cu投入大量AgNO3溶液中,得到固体为,若Fe有剩余,滤液中溶质为。酸+金属氧化物→→盐+水碱碱++非金属氧化物非金属氧化物→→盐盐++水水酸+碱→盐+水Fe、Ag、CuAgFe(NO3)2讨论制取MgSO4的可能方法有几种?从中选出三种最佳制法,写出相应的化学方程式。(1)金属+酸→盐+氢气(2)金属+盐→新金属+新盐(3)酸+金属氧化物→盐+水(4)酸+碱→盐十水(5)酸+盐→新盐+新酸(6)碱+非金属氧化物→盐+水(7)碱+盐→新碱+新盐(8)盐+盐→两种新盐根据物质间相互关系,制盐的可能方法有八种:1.写出制取ZnCl2的可能方法的化学方程式。2.写出由氧化铁制备氢氧化铁的有关反应的化学方程式。写一写