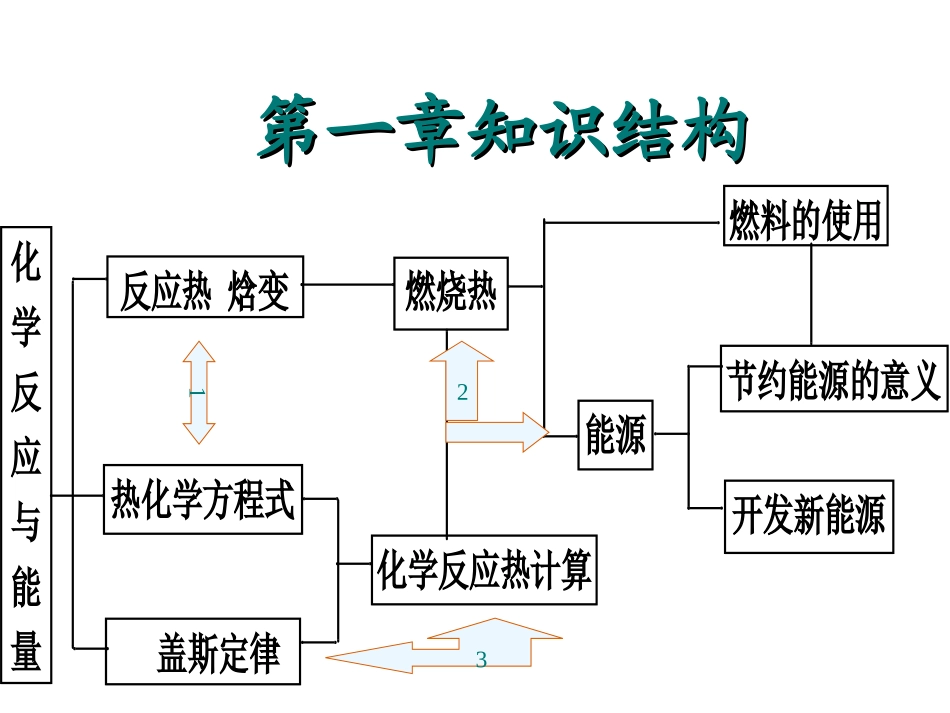
第一章知识结构第一章知识结构反应热焓变化学反应与能量化学反应热计算焓变燃烧热盖斯定律热化学方程式焓变节约能源的意义开发新能源能源燃料的使用132反应热焓变反应热焓变定义:在化学反应过程中放出或吸收的热定义:在化学反应过程中放出或吸收的热量量,,通常叫做通常叫做反应热反应热,,也称也称““焓变焓变””。。符号:用符号:用△△HH表示。表示。单位:一般采用单位:一般采用kJ/molkJ/mol。。△△H=H=反应物的鍵能总和反应物的鍵能总和--生成物的鍵能总生成物的鍵能总和和可直接测量,测量仪器叫量热计。可直接测量,测量仪器叫量热计。热化学方程式热化学方程式1.1.△△HH写在方程式的右边,用空格隔开,△写在方程式的右边,用空格隔开,△HH值“值“--””表示表示放热放热反应,△反应,△HH值“值“++””表示表示吸热吸热反应。单反应。单位“位“kJ/molkJ/mol””。。2.△H2.△H与测定条件有关,没有标明是指与测定条件有关,没有标明是指25℃25℃,,101KPa101KPa3.3.系数只表示物质的量,可以是分数。系数只表示物质的量,可以是分数。4.4.要注明反应物和生成物的聚集状态,通常用要注明反应物和生成物的聚集状态,通常用ss、、llgg表示固体、液体和气体,不用标“↓、↑”。表示固体、液体和气体,不用标“↓、↑”。5.△H5.△H的值要与化学计量数相对应。的值要与化学计量数相对应。6.6.正反应若为放热反应,则其逆反应必为吸热反应正反应若为放热反应,则其逆反应必为吸热反应二者△二者△HH的符号相反而数值相等。的符号相反而数值相等。燃烧热燃烧热概念概念::25℃25℃、、101kPa101kPa时时,1mol,1mol纯物质完全燃烧生纯物质完全燃烧生成稳定的化合物时所放出的热量成稳定的化合物时所放出的热量,,叫做该物质的叫做该物质的燃烧热燃烧热..注意注意::①①可燃物的化学计量数为可燃物的化学计量数为1,H<0,△1,H<0,△以此为标准配以此为标准配平平,,其它计量数可整数也可分数其它计量数可整数也可分数;;②②完全燃烧完全燃烧,,下列元素要生成对应的氧化物下列元素要生成对应的氧化物::C→COC→CO22(g)(g)H→HH→H22OO(l)(l)S→SOS→SO22(g)(g)盖斯定律盖斯定律定义定义::化学反应的反应热只与反应化学反应的反应热只与反应体系的始态和终态有关体系的始态和终态有关,,而与反应途径而与反应途径无关无关..注意注意①①热化学方程式同乘以某一个数时热化学方程式同乘以某一个数时,,反应反应热热数值也应该乘上该数数值也应该乘上该数;;②②热化学方程式相加减时热化学方程式相加减时,,同种物质之间同种物质之间可可以相加减以相加减,,反应热也随之相加减反应热也随之相加减;;③③将一个热化学方程式颠倒时将一个热化学方程式颠倒时,H△,H△的“的“++””““--””号必须随之改变号必须随之改变..