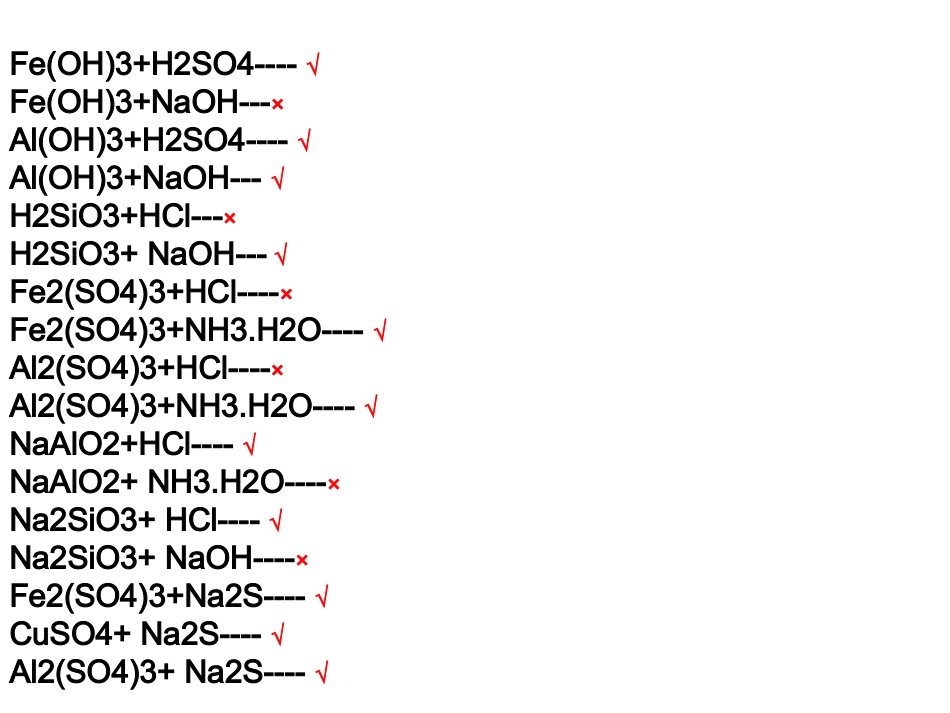
请判断下列物质间的反应能否发生,若不能则打叉,若能发生的请写出反应的离子方程式:Fe+HCl---√Fe+NaOH---×Al+HCl----√Al+NaOH----√Cl2+HCl----×Cl2+NaOH----√Si+HCl---×Si+NaOH---√Fe2O3+HCl----√Fe2O3+NaOH----×Al2O3+HCl----√Al2O3+NaOH----√SO2+HCl----×SO2+NaOH----√SiO2+HCl----×SiO2+NaOH----√Fe(OH)3+H2SO4----√Fe(OH)3+NaOH---×Al(OH)3+H2SO4----√Al(OH)3+NaOH---√H2SiO3+HCl---×H2SiO3+NaOH---√Fe2(SO4)3+HCl----×Fe2(SO4)3+NH3.H2O----√Al2(SO4)3+HCl----×Al2(SO4)3+NH3.H2O----√NaAlO2+HCl----√NaAlO2+NH3.H2O----×Na2SiO3+HCl----√Na2SiO3+NaOH----×Fe2(SO4)3+Na2S----√CuSO4+Na2S----√Al2(SO4)3+Na2S----√各类物质的通性归纳:1、金属、金属氧化物(碱性氧化物)、碱的通性:与酸反应,不与碱反应排在金属活动顺序表中铜前的金属,与非氧化性的酸(稀盐酸、稀硫酸)生成盐和氢气碱性氧化物、碱与酸反应,生成盐加水。2、非金属、酸性氧化物、酸的通性:非金属与碱反应较复杂,要记。酸性氧化物、酸:与碱反应,生成盐和水。3、盐的通性:盐遇到其它物质,先判断是否有氧化还原反应,优先氧化还原反应,若不能发生氧化还原反应,则为复分解反应或双水解反应。所以必须记住强氧化性的物质和强还原性的物质,两强相遇则发生氧化还原反应,不是两强则不行。酸碱盐氧化物关系图金属及其化合物学习方法:1、了解通性,掌握特性:Na:极活泼Al:两性(铝三角)Fe:变价(+2、+3铁三角)2、学习思路:结构--性质--用途(保存、灭火)Na---Na2O、Na2O2---NaOH---Na2CO3、NaHCO3重点性质:Na2O2的碱性、强氧化性、漂白性,NaOH与酸反应的量的问题,Na2CO3、NaHCO3的鉴别及相互转换3、延深至同族元素的性质,相似性、递变性。