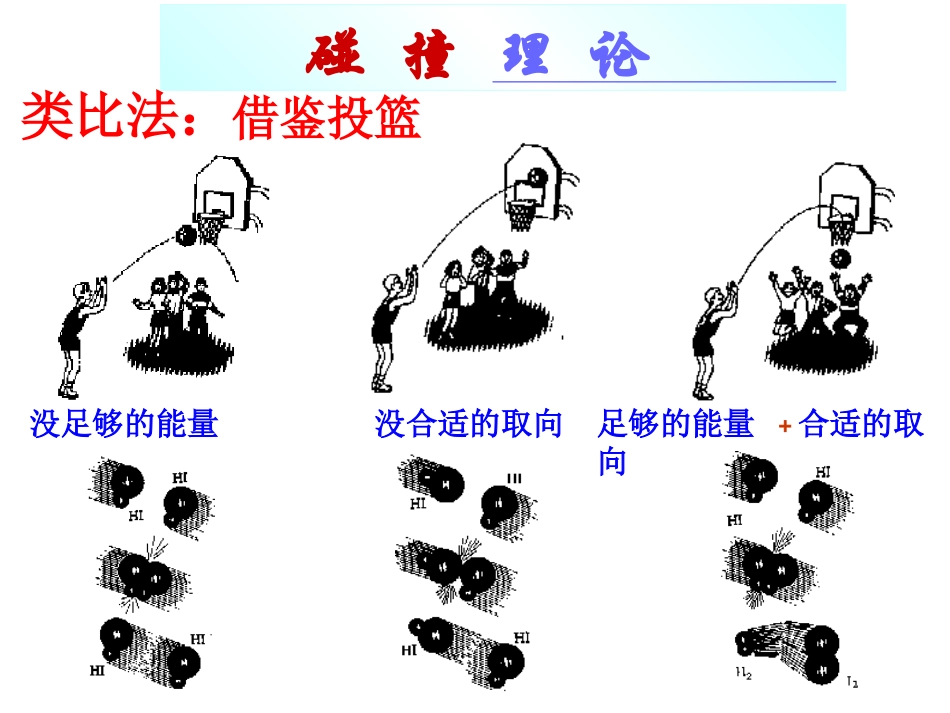
第二节影响化学反应速率的因素影响反应速率的因素(2)外部因素:(1)内部因素(主要因素):决定化学反应速率的因素是参加反应的物质本身的化学性质。①浓度,②压强,③温度,④催化剂,⑤其他因素:光、固体颗粒表面积、反应物的状态、原电池原理等。复习:没合适的取向没足够的能量足够的能量+合适的取向类比法:借鉴投篮碰撞理论能够发生化学反应的碰撞。有可能发生有效碰撞的分子。活化分子所多出普通分子的那部分能量E1。(即活化分子能量与反应物分子平均能量之差)有效碰撞:活化分子:活化能:n活=n总×活%活化分子百分数:(活化分子数/反应物分子数)×100%E1——表示活化能,E2——表示活化分子变成生成物分子释放的能量E2-E1——表示反应热有效碰撞次数越多,化学反应的速率就越大吗?反应速率越大单位时间单位体积有效碰撞次数越多单位体积活化分子数越多甲:一分钟有效碰撞100次乙:十分钟有效碰撞500次甲、乙相同条件下反应甲:整个容器中有效碰撞300次乙:半个容器中有效碰撞150次单位时间单位体积的有效碰撞次数又是由什么决定的呢?活化能的大小和反应速率有什么关系?活化能越低,单位体积内活化分子数越多,有效碰撞频率越大,化学反应速率就会越快。一个反应经历的过程一个反应经历的过程普通分子活化能活化分子合理取向的碰撞有效碰撞新物质能量一、浓度对反应速率的影响1、在其他条件不变时,增大反应物浓度,可以增大反应速率;减小反应物的浓度,可以减小化学反应的速率。实验2-2结论:浓度大的H2C2O4(aq)先褪色2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O浓度对反应速率的影响本质原因在其他条件不变时,对某一反应来说,活化分子百分数是一定的,即单位体积内的活化分子数与反应物的浓度成正比。所以当反应物的浓度增大时,单位体积内的分子数增多,活化分子数也相应的增多,有效碰撞的频率增加,反应速率增大。a、此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它们的量一般不会改变化学反应速率。c、随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。注意:b、一般来说,固体反应物表面积越大,反应速率越大,固体反应物表面积越小,反应速率越小。例题1:一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2反应中,为了加快反应的速率,下列那些方法可行:A、增加HCl的浓度B、加水C、增加同浓度盐酸的量D、改加CaCO3粉末二、压强对反应速率的影响【原因】气体压强增大,体积减小,气体浓度增大,单位体积内分子数增多,活化分子数也相应增加,反应速率增大。【结论】其它条件不变时,有气体参加的反应中,增大压强,反应速率加快;减小压强,反应速率减慢。注意:1、压强对反应速率的影响适用于有气体参加的反应。3、对于反应物和生成物都有气体的可逆反应,增大压强,正、逆反应速率都增大;减小压强,正、逆反应速率都减小。2、由于固体、液体粒子间的空隙很小,增大压强几乎不能改变它们的浓度,因此对只有固体或液体参加的反应,压强的变化对于反应速率的影响可以忽略不计。思考:在N2+3H22NH3中,当其他外界条件不变时:Ⅰ、减小体系压强,该反应的速率怎么变?Ⅱ、反应中保持体系容积不变,充入N2,反应的速率怎么变?Ⅲ、反应中保持体系容积不变,充入He,反应的速率怎么变?Ⅳ、反应中保持体系压强不变,充入He,反应的速率怎么变?4、注意“真”变和“假”变。若体系的压强变化而使反应物或生成物的浓度发生变化即“真”变,否则是“假”变。总结压强对化学反应速率的影响:1、恒温时:增大压强→体积减少→C增大→反应速率增大2、恒温、恒容时:A、充入气体反应物→反应物浓度增大→总压增大→反应速率增大;B、冲入“无关气体”(如He、N2等)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变3、恒温、恒压时:冲入“无关气体”(如He等)→引起体积增大→各反应物浓度减少→反应速率减慢。例2:对于反应N2+O2=2NO在密闭容器中进行,下列条件哪些不能加快该反应的化学反应速率()A、缩小体积使压强增大B、体积不变充入N2使压强...