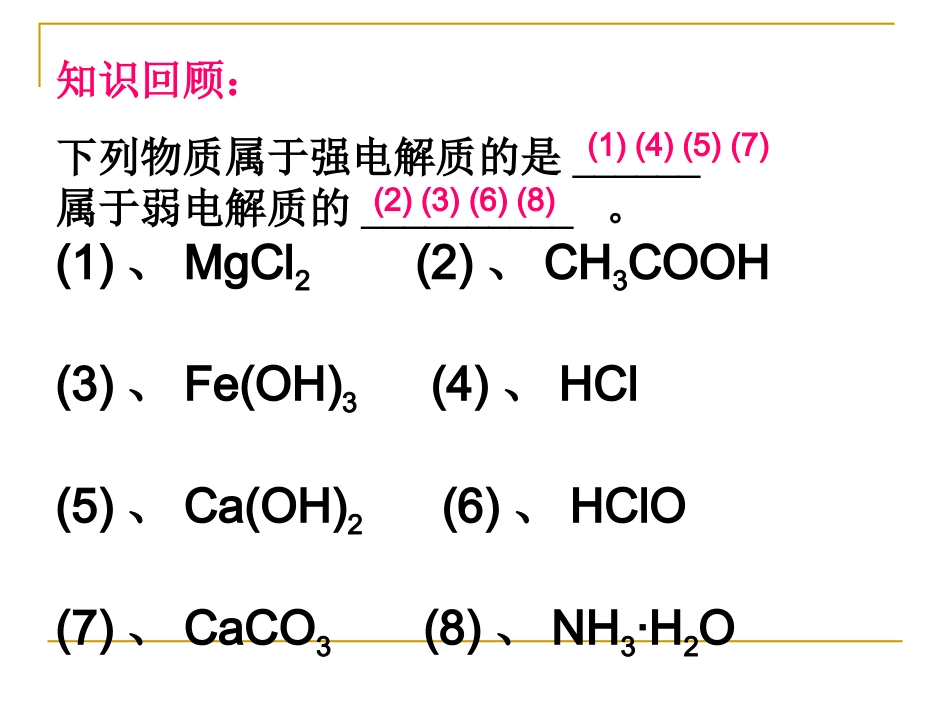
第一节弱电解质的电离第一节弱电解质的电离第三章水溶液中的离子平衡第三章水溶液中的离子平衡知识回顾:下列物质属于强电解质的是______属于弱电解质的__________。(1)、MgCl2(2)、CH3COOH(3)、Fe(OH)3(4)、HCl(5)、Ca(OH)2(6)、HClO(7)、CaCO3(8)、NH3·H2O(2)(3)(6)(8)(1)(4)(5)(7)一、弱电解质的电离CHCH33COOHCOOHCHCH33COOCOO--++HH++电离结合思考与讨论:思考与讨论:(2)2)当当VV电离电离=V=V结合结合时,可逆过程达到一时,可逆过程达到一种什么样的状态。种什么样的状态。(1)1)开始时,开始时,VV电离电离和和VV结合结合怎样变化?怎样变化?你能画出这个过程的你能画出这个过程的VV~~tt图吗?图吗?二、电离平衡状态反应速率V(电离)V(结合)V(电离)=V(结合)电离平衡状态弱电解质电离平衡状态建立示意图时间CH3COOHCH3COO-+H+讨论:电离平衡受哪些因素影响?怎样影响?以CH3COOH为例说明。电离平衡和化学平衡一样,当外界条件电离平衡和化学平衡一样,当外界条件改变时符合勒夏特列原理。改变时符合勒夏特列原理。改变条件平衡移动方向C(H+)C(CH3COO---)C(CH3COOH)加热加盐酸加NaOH加CH3COONa加CH3COOH加水稀释正向移动增大增大减少逆向移动增大减少增大正向移动减少增大减少逆向移动减少增大增大正向移动增大增大增大正向移动减少减少减少讨论完成表格:CH3COOHCH3COO--+H+三.影响电离平衡的因素1、内因:电解质本身的性质。通常电解质越弱,电离程度越小。2、外因:温度升高温度有利于电离(因为电离过程是吸热的)浓度A、稀释有利于电离B、加入与弱电解质具有相同离子的强电解质会抑制电离(同离子效应)C、加入能与弱电解质电离产生的某种离子反应的物质可促进电离(离子反应效应)例:在氨水中存在怎样的电离平衡?若向例:在氨水中存在怎样的电离平衡?若向其中分别加入其中分别加入::①①适量的盐酸②适量的盐酸②NaOHNaOH溶液溶液③③NHNH44ClCl溶液④大量的水溶液④大量的水⑤⑤加热⑥氨气加热⑥氨气对上述电离平衡有什么影响?对上述电离平衡有什么影响?思考与讨论:思考与讨论:NHNH33·H·H22ONHONH44+++OH+OH--小结小结::**弱电解质的电离平衡弱电解质的电离平衡①①电离平衡状态电离平衡状态②②电离平衡特点电离平衡特点③③影响电离平衡的因影响电离平衡的因素素B1.在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是()A.加入水时,平衡向逆反应方向移动.B.加入少量NaOH固体,平衡向正反应方向移动.C.加入少量0.1mol/LHCl溶液,溶液中C(H+)减少.D.加入少量CH3COONa固体,平衡向正反应方向移动.2.把Ca(OH)2放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)Ca2++2OH-加入以下溶液,可使Ca(OH)2减少的是()A、Na2S溶液B、AlCl3溶液C、NaOH溶液D、CaCl2溶液B3.课堂练习1、向H2S溶液中加入CuSO4溶液时,电离平衡向移动,c(H+),c(S2-);2、向H2S溶液中加入NaOH固体时,电离平衡向移动,c(H+),c(S2-);3、若将H2S溶液加热至沸腾,c(H2S);4、若要同时增大H2S溶液中c(S2-)、c(H+),可以采取的措施.右右增大增大减小减小减小升高温度,通入H2S气体等