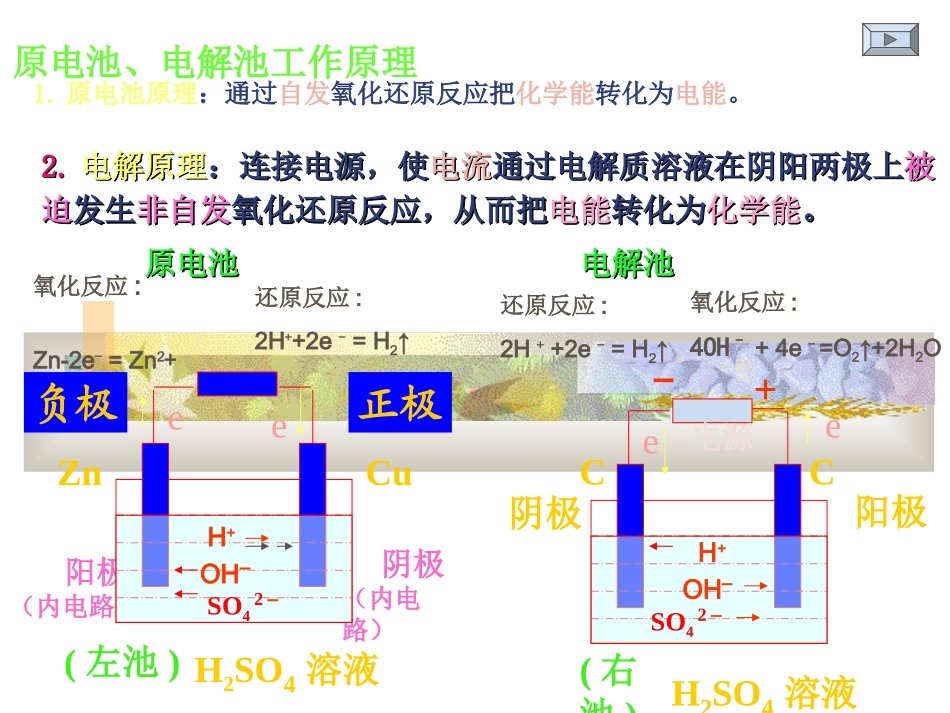
(2009年高考二轮专题复习)【学习目标】1、掌握原电池、电解池的概念及原理,了解铜的电解精炼、镀铜、氯碱工业反应原理2、学会电极的判断,学会正确书写电极反应及总反应方程式,掌握常见离子放电的规律;3、能运用得失电子守恒法解决电化学的相关计算。高考化学二轮专题《电化学》复习高考化学二轮专题《电化学》复习【复习重点】原电池、电解原理及应用;电极反应方程式书写【知识概括】一个反应:氧化还原反应一个计算:得失电子守恒法解决电化学的相关计算两个转化:化学能和电能的相互转化两个应用:原电池原理应用、电解原理应用三个条件:原电池、电解池的形成条件四个池子:原电池、电解池、电镀池、电解精炼池【专题难点】电极反应及总反应方程式正确书写一、原电池、电解池工作原理1.原电池原理:通过自发氧化还原反应把化学能转化为电能。2.2.电解原理电解原理:连接电源,使:连接电源,使电流电流通过电解质溶液在阴阳两极上通过电解质溶液在阴阳两极上被被迫迫发生发生非自发非自发氧化还原反应,从而把氧化还原反应,从而把电能电能转化为转化为化学能化学能。。阳极(内电路)阴极(内电路)CCH2SO4溶液阳极阴极+-ee电源正极负极CuZnH2SO4溶液eeH+SO42–H+SO42–氧化反应:Zn-2e-=Zn2+还原反应:2H++2e-=H2↑还原反应:2H++2e-=H2↑氧化反应:4OH–+4e-=O2↑+2H2O(左池)(右池)原电池原电池电解池电解池OH–OH–原电池电解池定义(能量转化)化学能转变成电能的装置。将电能转变成化学能的装置。形成条件①活动性不同两电极(燃料电池电极除外)②电解质溶液(有选择性)③两电极必须插入电解质溶液中(或两电极相靠)形成闭合回路①两电极接直流电源(两电极活动性可相同,也可不同)②电解质溶液(任意)③两电极必须插入电解质溶液中形成闭合回路电极名称电极判断负极:较活泼金属正极:较不活泼金属(或能导电的非金属等)阳极:电源正极相连阴极:电源负极相连电极反应得失电子负极(内电路为阳极):发生氧化反应(失电子)正极(内电路为阴极):发生还原反应(溶液中的阳离子移向正极得电子)阳极:发生氧化反应(电极或溶液中的阴离子移向阳极失电子)阴极:发生还原反应(溶液中的阳离子移向阴极失电子)电子流向负极正极负极阴极;阳极正极二、四池比较二、四池比较池型(原理)电解池电镀池(应用电解原理)铜的精炼池(应用电解原理)装置特征阳极:惰性电极Pt、Au、C、Ti(或活性电极)阴极:惰性、活性电极均可电解液:任意阳极:镀层金属(M)阴极:镀件电镀液:含镀层金属离子(Mn+)阳极:粗铜(含Zn、Fe、Ni、Ag、Pt、Au等)阴极:精铜电解液:CuSO4溶液电极反应阳极:易放电的阴离子首先放电(或电极参与反应)阴极:易放电的阳离子首先放电阳极:M-ne-=Mn+阴极:Mn++ne-=M阳极:Cu-2e-=Cu2+(Zn-2e-=Zn2+,Fe-2e-=Fe2+等)阴极:Cu2++2e-=Cu(Ag、Pt、Au以金属单质沉积于阳极,成为“阳极泥”)电解质溶液的浓度改变不变基本不变常见阴阳离子放电顺序(离子浓度接近时)阳离子放电(得电子)由难到易KK++CaCa2+2+NaNa++MgMg2+2+AlAl3+3+((HH++)Zn)Zn2+2+FeFe2+2+PbPb2+2+((HH++)Cu)Cu2+2+FeFe3+3+HgHg2+2+AgAg++阴离子放电放电(失电子)由难到易由难到易::FF--ROROmmnn--OHOH--ClCl--BrBr--II--SS22--1.金属腐蚀:(1)化学腐蚀(2)电化腐蚀a.析氢腐蚀b.吸氧腐蚀2.防护方法:(1)改变金属内部组织结构(2)在金属表面覆盖保护(3)电化学保护法(牺牲阳极的阴极保护法)3.制造新化学电源:如太阳能电池、核电池、燃料电池、银-锌电池碱性蓄电池、银-锌电池、浓差电池等)★★原电池应用原电池应用说明:①电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀②同一种金属的腐蚀:强电解质>弱电解质>非电解质【思考题】下列装置中的纯锌棒都浸在相同浓度的稀硫酸中,锌棒腐蚀速度从快到慢的顺序是()AB③④②①②③①④CD④②①③③②①④DD★电解原理的应用11、镀铜反应原理、镀铜反应原理阳极阳极((纯铜纯铜))::Cu-2e—=Cu2+Cu-2e—=Cu2+,,阴极阴极((镀件镀件))::Cu2++2e—=CuCu2++2e—=Cu,,电解液:可溶性铜盐溶液,如电解液:可溶性铜盐溶液,如CuSO...