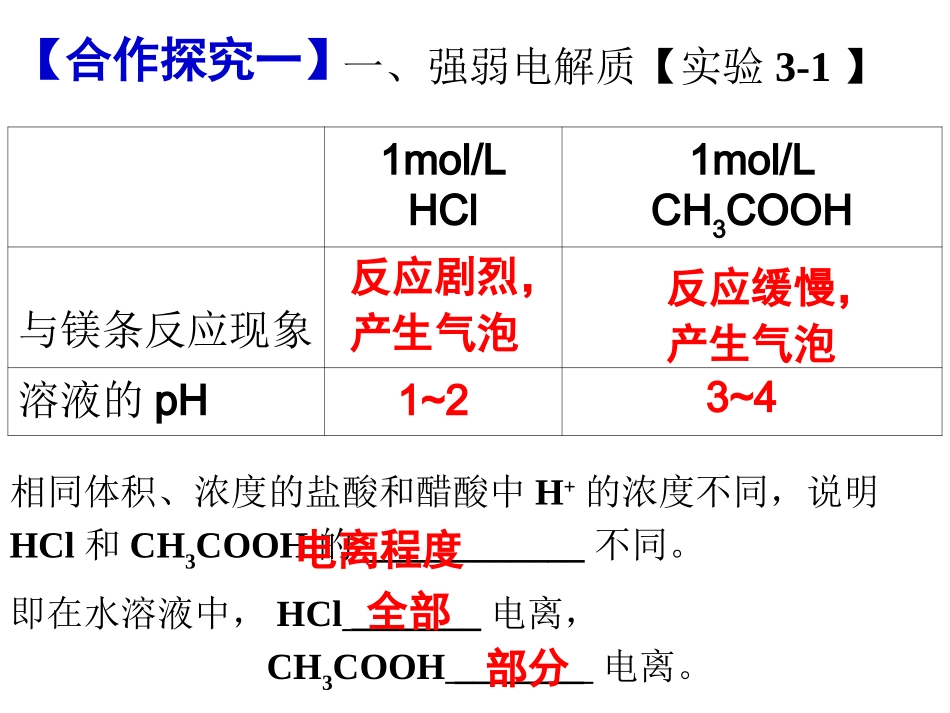
弱电解质的电离(第一课时)强、弱电解质及电离方程式的书写黎玉珠【预习案】G1展示,G2点评。1mol/LHCl1mol/LCH3COOH与镁条反应现象溶液的pH反应剧烈,产生气泡反应缓慢,产生气泡1~23~4【合作探究一】一、强弱电解质【实验3-1】相同体积、浓度的盐酸和醋酸中H+的浓度不同,说明HCl和CH3COOH的____________不同。即在水溶液中,HCl_______电离,CH3COOH_______电离。电离程度全部部分强电解质:弱电解质:【定义生成】如:__________________________________如:_________________________________G3展示强电解质:弱电解质:在水溶液中,能够全部电离的电解质。在水溶液中,仅部分电离的电解质。【定义生成】如:__________________________________如:_________________________________强酸、强碱、大部分的盐弱酸、弱碱、水和极少数的盐【小组合作】先独立完成自检1,遇到困难可小组讨论。G3展示【合作探究二】电离方程式的书写1、自学完成(1)(2)点内容,想一想电离方程式书写的关键是什么?(1)强电解质____电离,书写电离方程式时用“______”。(2)弱电解质____电离,书写电离方程式时用“_____”。全部部分区分强弱电解质【合作探究二】电离方程式的书写2、完成【练习】。NaFNaHCO3H2SO4H3PO4CH3COOHNaOHNH3·H2ONaHSO4(水溶液中)NaHSO4(熔融时)H2CO3Fe(OH)3G4展示G5展示G6展示G7点评G8点评G9点评强电解质弱电解质概念化合物类型化学键类型电离程度溶液中存在的微粒电离过程(是否可逆)【归纳总结】强弱电解质的比较全部为阴、阳离子阴、阳离子、电解质分子离子键、共价键共价键全部部分二、溶液导电性强弱与电解质强弱的关系【思考】1、电解质溶液为什么能导电?2、电解质溶液导电能力与什么有关?导电性实验相同条件下,不同电解质溶液导电能力的比较自由移动的离子【小组合作】小组讨论完成【练习】2。G4展示【练习】2、下列各种溶液中通入或加入少量物质,使溶液导电能力增强的是()A.盐酸中通入少量NH3B.氨水中通入少量HClC.醋酸中通入少量NH3D.盐酸中加入少量AgNO3【小结2】电解质溶液的导电能力取决于_________________和______________________。自由移动离子的浓度离子所带的电荷