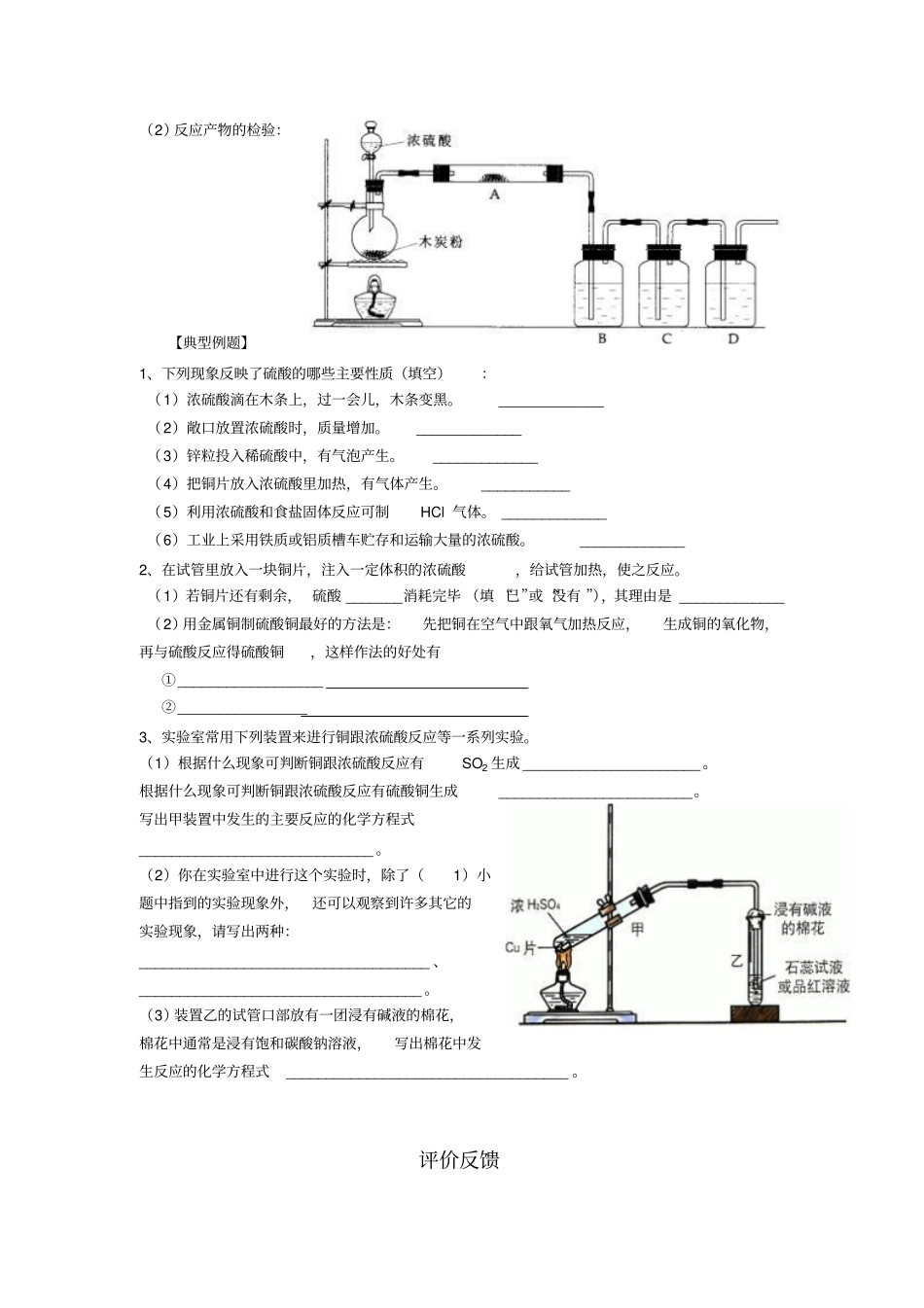
高中化学学习材料(灿若寒星**整理制作)自学导引【基础知识构建】一、硫酸的性质1、硫酸是一种挥发强酸,沸点高,粘稠状液体,98%浓硫酸的密度为1.84g/cm3,2、硫酸是一种二元强酸,H2SO4==2H++SO42-,具有酸的通性(1)与指示剂作用(石蕊):(2)与活泼金属反应放出H2(Zn):(3)与金属氧化物反应(Fe2O3):(4)与碱反应(NaOH):(5)与盐反应(BaCl2):3、浓硫酸的稀释方法二、硫酸根的检验:1、加入BaCl2能够产生的沉淀的常见离子有,离子方程式分别为,2、检验SO42-的方法是:先加无现象,再加,产生白色沉淀。离子方程式为【自主检测】1、以下是一些常用危险化学品的标志,其中装运浓硫酸的包装箱应贴的图标是ABCD2、ag铁粉与含有H2SO4的CuSO4溶液完全反应后,得到ag铜,则参与反应的CuSO4与H2SO4的物质的量之比为A.1︰7B.7︰1C.7︰8D.8︰73、已知98%的浓硫酸物质的量浓度为18.4mol·L-1,则49%的硫酸溶液物质的量浓度A.等于9.2mol·L-1B.大于9.2mol·L-1C.小于9.2mol·L-1D.不能确定4、下列变化中,能证明硫酸是强酸的事实是A.能使石蕊试液变红B.能跟磷酸钙反应制磷酸C.能跟氯化钠反应制氯化氢D.能跟锌反应产生氢气5、检验某未知溶液中是否含有SO42-的下列操作中,最合理的是A.加入硝酸酸化了的硝酸钡溶液B.先加硝酸酸化,再加硝酸钡溶液C.加入盐酸酸化了的氯化钡溶液D.先加盐酸酸化,再加氯化钡溶液交流提升【知识体系完善】一、浓硫酸的吸水性与脱水性:1、吸水性:(1)吸水性的概念:(2)可作干燥剂,不能用浓硫酸干燥的气体为,干燥装置气体通入的方式是2、脱水性:(1)脱水性的概念:(2)实验:蔗糖中加入少量水,再加入浓硫酸搅拌。现象:结论:涉及的化学反应方程式为:二、浓硫酸的强氧化性:1、浓硫酸与铜的反应:(1)实验现象:(2)反应方程式:(3)标出其中电子转移的方向与数目并指出浓硫酸的作用:2、浓硫酸与铁的反应:(1)钝化:(2)钝化的条件:3、浓硫酸与碳的反应:(1)反应方程式:(2)反应产物的检验:【典型例题】1、下列现象反映了硫酸的哪些主要性质(填空):(1)浓硫酸滴在木条上,过一会儿,木条变黑。_____________(2)敞口放置浓硫酸时,质量增加。_____________(3)锌粒投入稀硫酸中,有气泡产生。_____________(4)把铜片放入浓硫酸里加热,有气体产生。___________(5)利用浓硫酸和食盐固体反应可制HCl气体。_____________(6)工业上采用铁质或铝质槽车贮存和运输大量的浓硫酸。_____________2、在试管里放入一块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。(1)若铜片还有剩余,硫酸_______消耗完毕(填“已”或“没有”),其理由是_____________(2)用金属铜制硫酸铜最好的方法是:先把铜在空气中跟氧气加热反应,生成铜的氧化物,再与硫酸反应得硫酸铜,这样作法的好处有①__________________②________________3、实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成______________________。根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成________________________。写出甲装置中发生的主要反应的化学方程式_____________________________。(2)你在实验室中进行这个实验时,除了(1)小题中指到的实验现象外,还可以观察到许多其它的实验现象,请写出两种:____________________________________、___________________________________。(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式___________________________________。评价反馈1、浓硫酸有许多重要的性质,在与含有永分的蔗糖作用过程中不能显示的性质是A.酸性B.脱水性C.强氧化性D.吸水性2、下列反应中,浓硫酸既表现强氧化性,又表现酸性的是A.2NaCl(固)+H2SO4Na2SO4+2HCl↑B.C+2H2SO4(浓)CO2↑+2SO2↑+2H2OC.Cu+2H2SO4(浓)CuSO4+SO2↑+2H2OD.2FeO+4H2SO4(浓)==Fe2(SO4)3+SO2↑+4H2O3、把浓硫酸滴入浓盐酸中,会有氯化氢气体逸出,对此现象的合理解释是A.氯化氢难溶于水B.浓硫酸有脱水性C....