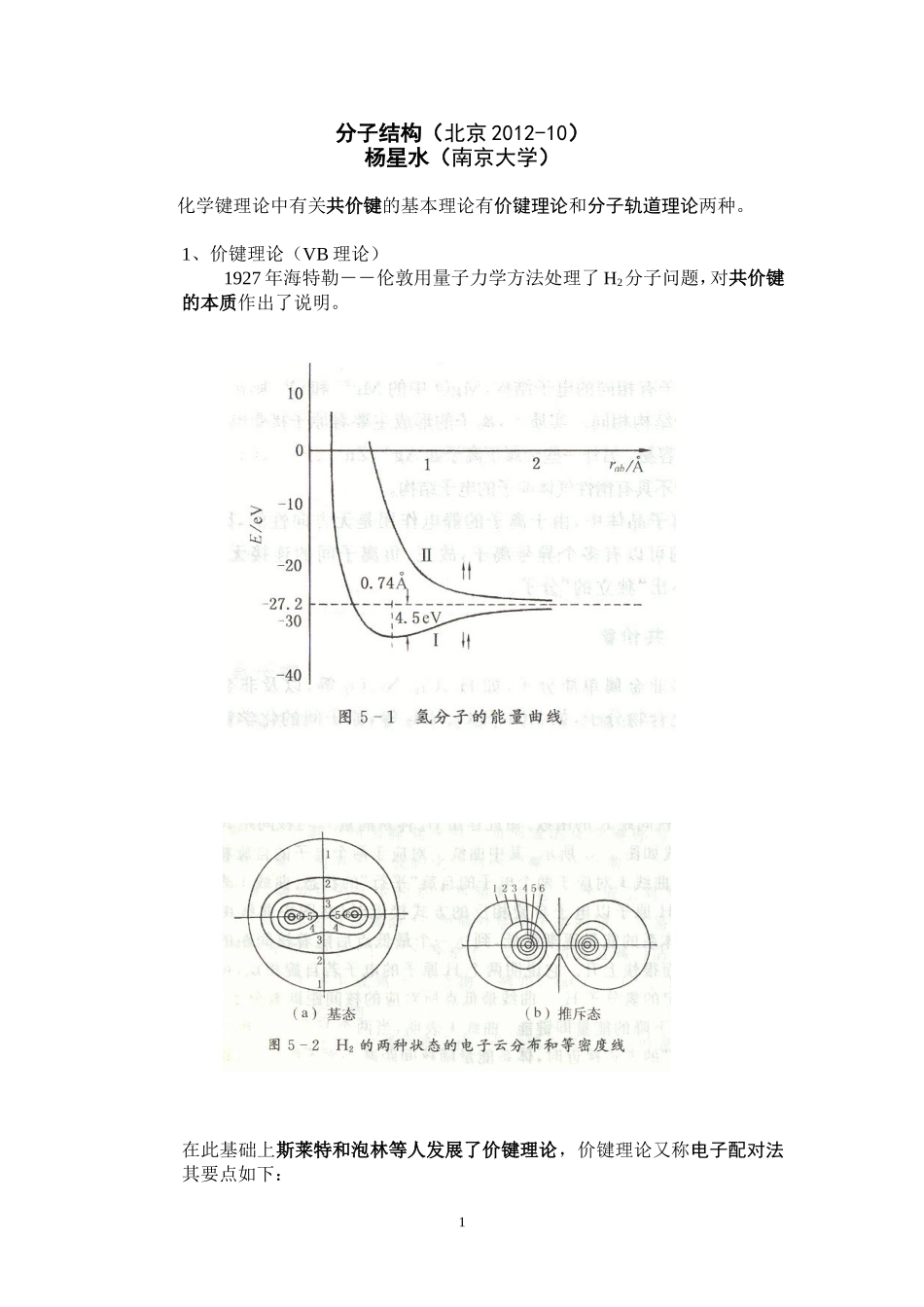
分子结构(北京2012-10)杨星水(南京大学)化学键理论中有关共价键的基本理论有价键理论和分子轨道理论两种。1、价键理论(VB理论)1927年海特勒――伦敦用量子力学方法处理了H2分子问题,对共价键的本质作出了说明。在此基础上斯莱特和泡林等人发展了价键理论,价键理论又称电子配对法其要点如下:1①电子配对②原子价③饱和性④方向性(最大重叠)⑤配位键举例:[Re2Cl8]2-的结构和成键情况。Re原子的外层电子构型是5d56s2,因此Re3+为d4离子。Re3+和4个Cl-离子形成的平面正方形配位结构,是由Re3+在平面正方形配位时的能量最高的空d轨道5dx2-y2轨道与6s、6px、6py杂化的4个杂花轨道5dx2-y2-6s-6px-6py与4个Cl-离子配位形成。Re-Re四重键:dz-pz杂化轨道成σ键(杂化以提高成键能力);dzx-dzx成π键;2dyz-dyz成π键;dxy-dxy成δ键。2、分子轨道(MO)理论休克尔、洪特、慕利肯等人发展了分子轨道理论。分子轨道理论可以看成是量子力学方法处理氢分子问题所得结果——描述分子中单个电子运动状态的波函数——的推广。(1)MO理论要点:①单电子近似(MO)。②由原子轨道的线性组合得到分子轨道(LCAO),MO数等于AO数。③成键的原则:对称匹配(SALC)、能量相近,最大重叠。对称匹配能量相近3B=最大重叠最大重叠导致共价键的方向性。④分子的电子组态(电子构型)(能量最低、泡利原理、洪特规则)4(2)MO的类型567H2分子的分子轨道(键能为-2β)8910111213(3)休克尔分子轨道法(HMO)(处理共轭键的方法)以丁二烯为例HOMO、LUMO、FMO。3、分子的立体构型(1)杂化(原子)轨道理论(属VB理论范畴)14及配合物中央原子(离子)的含d轨道杂化:①八面体:②四面体:③平面正方形:④三角双锥:四方锥:(2)价电子对互斥理论①电子对与构型②单键、重键、孤对电子的不同作用③中心原子与配位原子二者电负性的影响若干分子的成键原理举例:(配位键)结果与VB理论一致15离域键结构举例:(二聚)稳定羧酸两个(完)16