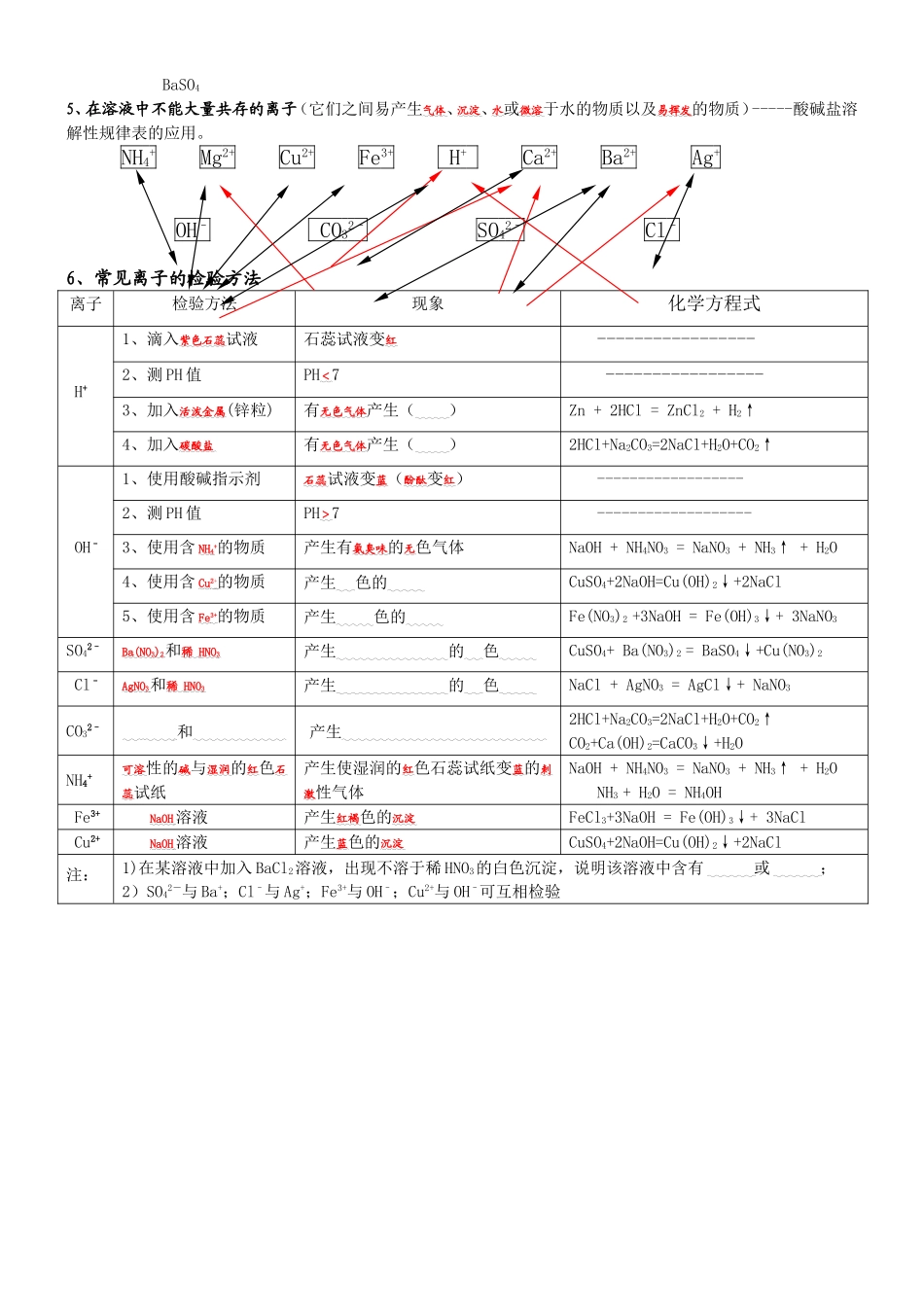
遇酸不溶解遇酸溶解且放出CO2气体有色物质的分离和提纯分离:是指把混合物中的不同成分分开的操作,分离后的各物质均保持不变。提纯:(又称作除杂)则是指把某物质中混有的杂质除去的操作,不要求保留杂质。其方法有:(一)物理方法:1、过滤(详情见“基本操作”)2、结晶:适用于可溶性固体与液体的分离。【注】:结晶又可分为:(1)蒸发结晶:适用于溶解度受温度影响改变不大的可溶性固体与液体的分离。(详情见“基本操作”)(2)冷却热饱和溶液结晶:适用于溶解度受温度影响较大的可溶性固体与液体的分离。(二)化学方法:利用化学反应将混合物中某一种成分转化为气体、沉淀、水等易分离的物质而除去,或将其转变成另一种成分。主要包括:1、生成气体:如用稀HCl除去中NaCl的Na2CO3:2HCl+Na2CO3=2NaCl+H2O+CO2↑2、生成沉淀:如用NaCl除去NaNO3中的AgNO3:NaCl+AgNO3=AgCl↓+NaNO33、生成水:如用稀HCl除去NaCl中的NaOH:HCl+NaOH=NaCl+H2O4、加热(或灼烧):如除去CaO中的CaCO3:CaCO3高温CaO+CO2↑;除去CuO中的Cu粉:2Cu+O2△2CuO5、吸收(多适用于气体混合物):如用NaOH溶液除去CO中的CO2:2NaOH+CO2=Na2CO3+H2O【注意】:先考虑物理方法,再考虑化学方法。不能引入新杂质,最好能把杂质转化为保留物。如(二)中的1、2、3、4;采用化学方法时,除杂试剂一般只跟杂质反应,且产物易分离。若被提纯物(保留物)也发生了变化,分离后应设法把其还原。物质的检验(物质的检验一般包括鉴定、鉴别和推断等类型。)鉴定:是根据一种物质的特性,用化学方法检验它是不是这种物质(若是离子化合物,必须检验出它的阳离子和阴离子)。鉴别:几种物质在一起,根据它们的不同特性,区别它们各是什么物质。推断:是根据已知的实验步骤和实验现象,运用物质的特性进行分析,通过推理,判断被检验的样品是什么物质,或含有什么物质,不含有什么物质。1、常见的离子在溶液中的颜色:Cu2+---蓝色;Fe3+---棕黄色;Fe2+---浅绿色;2、常见的有色固体:绿色粉末:Cu2(OH)2CO3;黑色粉末:Cu、MnO2(金、碳粉(、铁粉(金;黑色固体:Fe3O4、Fe;红棕色固体:Cu(金属、Fe2O3(金属、P(非金属;3、常见气体的特性气体特性O2能使带火星的木条复燃或N2-----------------------------------不燃烧也不支持燃烧CO2能使澄清石灰水变浑浊水溶液显酸性能灭火(即不燃烧也不支持燃烧)H2最轻的气体还原性还原后生成水可燃性燃烧后只生成水CO毒性还原后生成CO2燃烧后只生成CO2CH4结构最简单的、相对分子质量最小的、有机物燃烧后既生成水又生成CO2NO2红棕色能形成酸雨SO2无色、具有刺激性气味NH3无色、具有刺激性的氨臭味水溶液显碱性4、常见的沉淀(碱、盐)及特点Cu(OH)2(蓝色)Fe(OH)3(红褐色)遇酸溶解Mg(OH)2--------BaCO3白色CaCO3AgClBaSO45、在溶液中不能大量共存的离子(它们之间易产生气体、沉淀、水或微溶于水的物质以及易挥发的物质)-----酸碱盐溶解性规律表的应用。NH4+Mg2+Cu2+Fe3+H+Ca2+Ba2+Ag+OH–CO32–SO42–Cl–6、常见离子的检验方法离子检验方法现象化学方程式H+1、滴入紫色石蕊试液石蕊试液变红-----------------2、测PH值PH<7-----------------3、加入活泼金属(锌粒)有无色气体产生()Zn+2HCl=ZnCl2+H2↑4、加入碳酸盐有无色气体产生()2HCl+Na2CO3=2NaCl+H2O+CO2↑OH–1、使用酸碱指示剂石蕊试液变蓝(酚酞变红)------------------2、测PH值PH>7-------------------3、使用含NH4+的物质产生有氨臭味的无色气体NaOH+NH4NO3=NaNO3+NH3↑+H2O4、使用含Cu2+的物质产生蓝色的沉淀CuSO4+2NaOH=Cu(OH)2↓+2NaCl5、使用含Fe3+的物质产生红褐色的沉淀Fe(NO3)2+3NaOH=Fe(OH)3↓+3NaNO3SO42–Ba(NO3)2和稀HNO3产生不溶于稀硝酸的白色沉淀CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2Cl–AgNO3和稀HNO3产生不溶于稀硝酸的白色沉淀NaCl+AgNO3=AgCl↓+NaNO3CO32–稀HCl和澄清的石水产生使澄清石灰水变浑浊的无2HCl+Na2CO3=2NaCl+H2O+CO2↑CO2+Ca(OH)2=CaCO3↓+H2ONH4+可溶性的碱与湿润的红色石蕊试纸产生使湿润的红色石蕊试纸变蓝的刺激性气体NaOH+NH4NO3=NaNO3+NH3↑+H2ONH3+H2O=NH4OHFe3+NaOH溶液产生红褐色的沉淀FeCl3+3NaOH=Fe(OH)3↓+3NaClCu2+NaOH溶液产生蓝色的沉淀CuSO4+2NaOH=Cu(OH)2↓+2NaCl注:1)在某溶液中加入BaCl2溶液,出现不溶于稀HNO3的白色沉淀,说明该溶液中含有SO42–或Ag+;2)SO42-与Ba+;Cl–与Ag+;Fe3+与OH–;Cu2+与OH–可互相检验