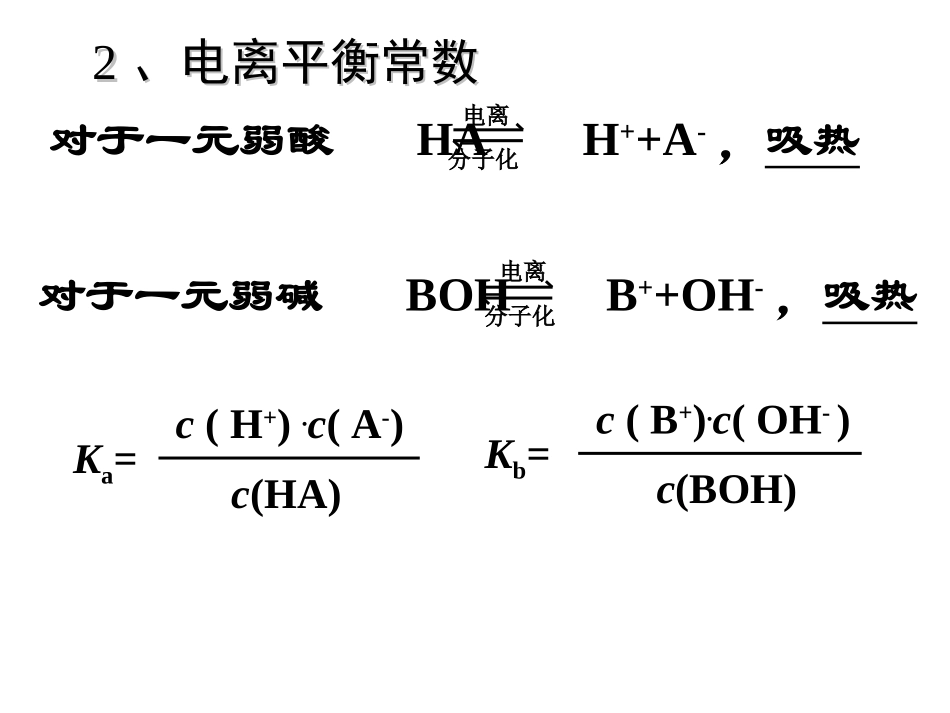
第三章第三章水溶液中的电离平衡水溶液中的电离平衡第一节弱电解质的电离第一节弱电解质的电离电离平衡和化学平衡一样,当外界条件改变时符合勒沙特列原理。11、弱电解质的电离平衡、弱电解质的电离平衡对于一元弱酸HAH++A-,吸热电离分子化对于一元弱碱BOHB++OH-,吸热分子化电离vt’tv电离v分子化三、弱电解质的电离平衡三、弱电解质的电离平衡电离平衡对于一元弱酸HAH++A-,吸热电离分子化对于一元弱碱BOHB++OH-,吸热分子化电离Ka=c(H+).c(A-)c(HA)Kb=c(B+).c(OH-)c(BOH)22、电离平衡常数、电离平衡常数33、影响电离平衡有哪些因素、影响电离平衡有哪些因素(1)温度:电离过程是吸热过程,温度升高平衡向电离方向移动。(越热越电离)(2)浓度:浓度越大,电离程度越小。(越稀越电离)(3)其他因素:加酸、加碱、加盐(同离子效应)5、向0.01mol·L-1醋酸溶液中分别加入下列物质,试填写下表:将0.lmol/LCH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起A.溶液的pH增加B.CH3COOH电离度变大C.溶液的导电能力减弱D.溶液中c(OH-)减小(A)