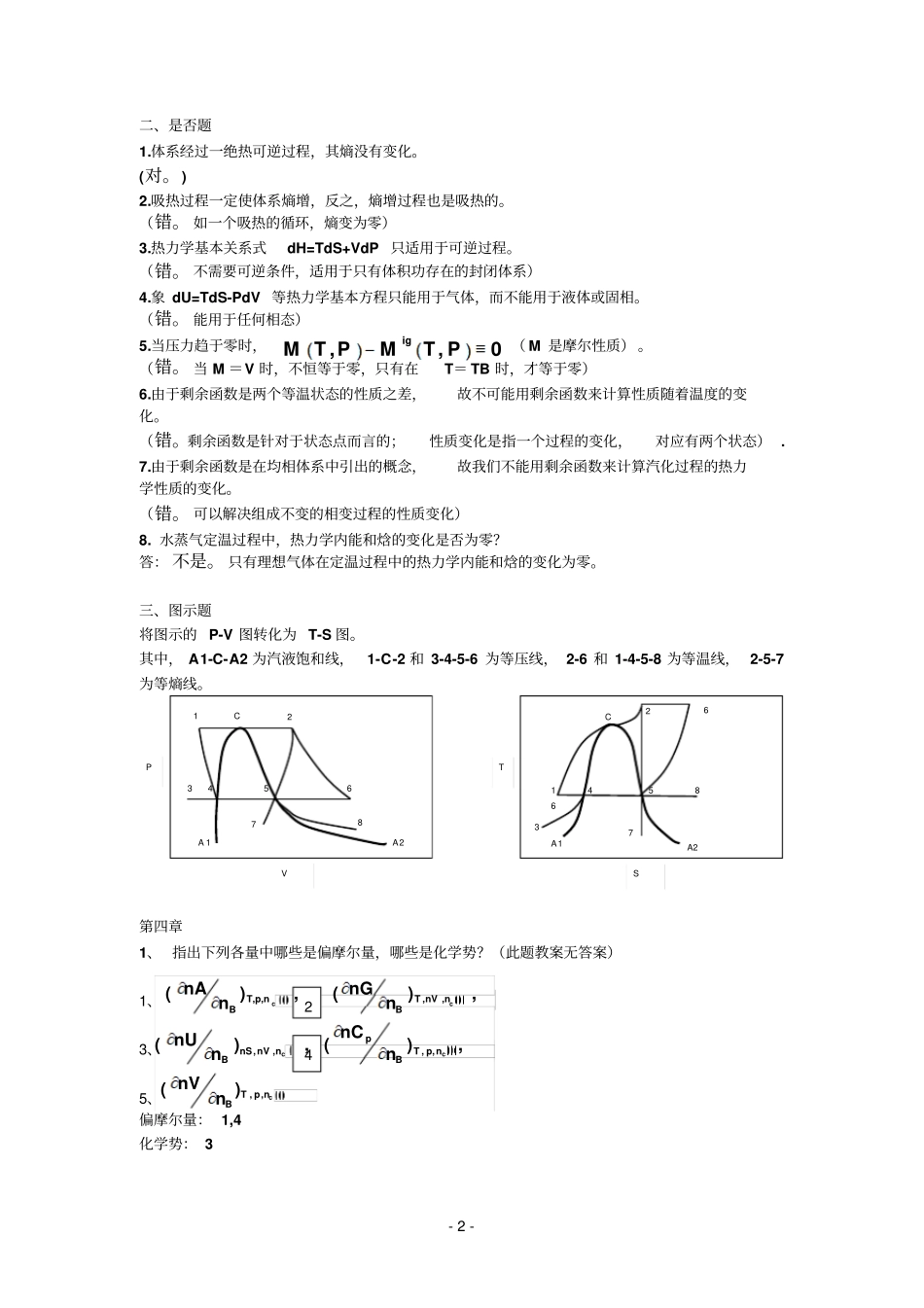
- 1 - 化工热力学第三章习题自测选择题1、对理想气体有:C 2 对单位质量,定组成的均相流体体系,在非流动条件下有: A A. dH = TdS + Vdp B.dH = SdT + Vdp C. dH = -SdT + Vdp D. dH = -TdS -Vdp 3、对 1mol 符合状态方程的气体,应是C A. R/V ;B. R ;C. -R/P ;D. R/T 。4、对 1molVan der Waals 气体,有A 。A. (?S/?V)T=R/(v-b) B. (?S/?V)T=-R/(v-b) C. (?S/?V)T=R/(v+b) D. ( ?S/?V)T=P/(b-v) 5、对 1mol 理想气体等于 __B___A. -R/V ;B. R/V ;C. R/P ;D. -R/P 。6、等于A 因为:7.吉氏函数变化与P-V-T 关系为, 则的状态应该为C A. T 和 P 下纯理想气体B. T 和零压的纯理想气体C. T 和单位压力的纯理想气体(C。因为).TSDV.VPCT.SVBT.VPAT0)/.(TPHA0)/.(TPHB0)/.(TPHC)/.(PTHDTSPPTSVPT1TTTSPTSPVTTTPVPTSPTSPPVSVPTVPTPSPVPTPVPVTT,lnigxGT PGRTPxG00(,),1lnlnigigGT PGT PRTP PRTP)/(bVRTPTPS )(()TS V- 2 - 二、是否题1.体系经过一绝热可逆过程,其熵没有变化。(对。) 2.吸热过程一定使体系熵增,反之,熵增过程也是吸热的。(错。 如一个吸热的循环,熵变为零)3.热力学基本关系式dH=TdS+VdP 只适用于可逆过程。(错。 不需要可逆条件,适用于只有体积功存在的封闭体系)4.象 dU=TdS-PdV 等热力学基本方程只能用于气体,而不能用于液体或固相。(错。 能用于任何相态)5.当压力趋于零时,( M 是摩尔性质) 。(错。 当 M =V 时,不恒等于零,只有在T= TB 时,才等于零)6.由于剩余函数是两个等温状态的性质之差,故不可能用剩余函数来计算性质随着温度的变化。(错。剩余函数是针对于状态点而言的;性质变化是指一个过程的变化,对应有两个状态) . 7.由于剩余函数是在均相体系中引出的概念,故我们不能用剩余函数来计算汽化过程的热力学性质的变化。(错。 可以解决组成不变的相变过程的性质变化)8. 水蒸气定温过程中,热力学内能和焓的变化是否为零?答: 不是。 只有理想气体在定温过程中的热力学内能和焓的变化为零。三、图示题将图示的 P-V 图转化为 T-S 图。其中, A1-C-A2 为汽液饱和线,1-C-2 和 3-4-5-6 为等压线, 2-6 和 1-4-5-8 为等温线, 2-5-7为等熵线。第四章1、 指出下列各量中哪些是偏摩尔量,哪些是化学势?(此题教案无答案)1、3、5、偏摩尔量: 1,4化学势: 3 A 1...