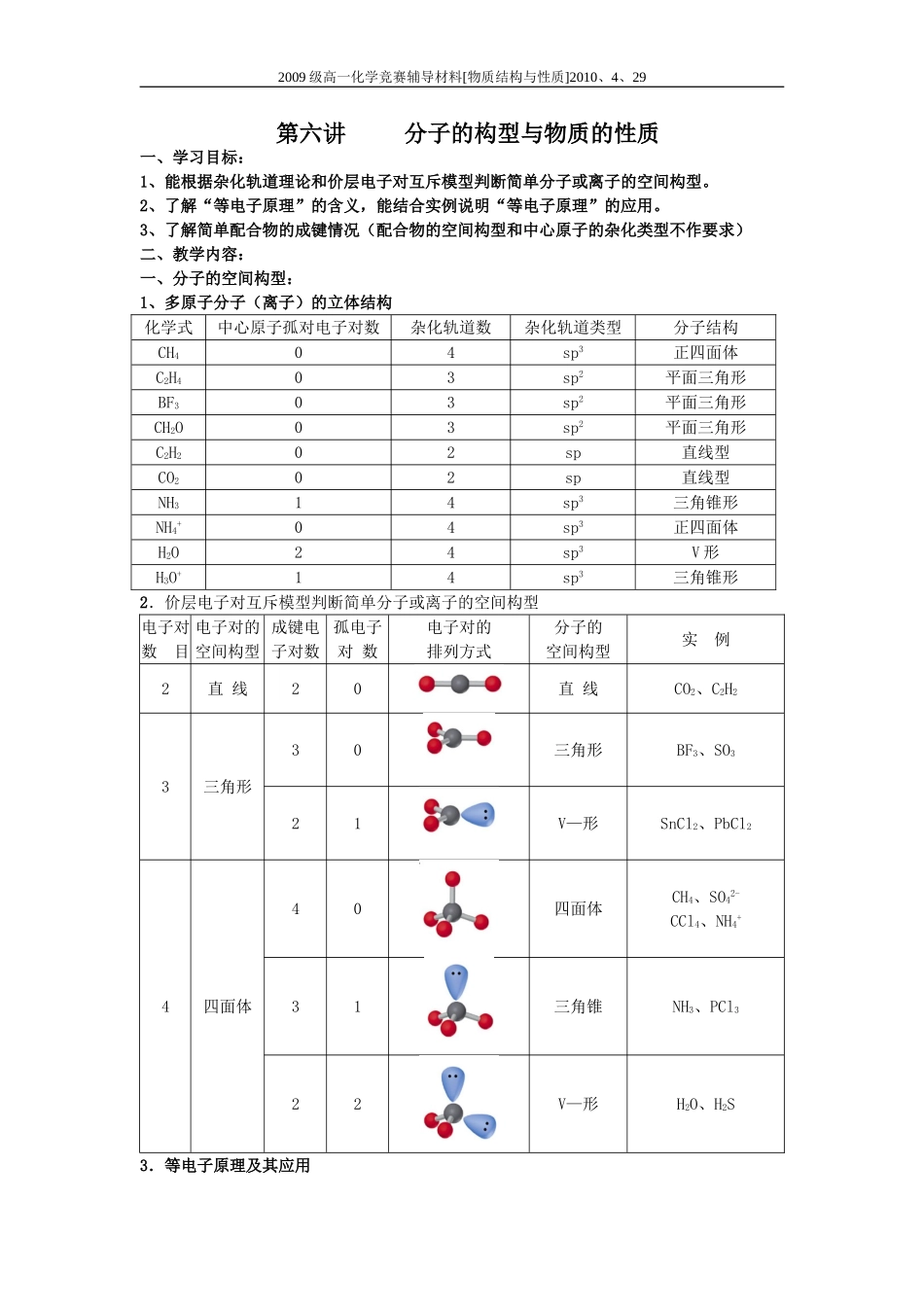
2009 级高一化学竞赛辅导材料[物质结构与性质]2010、4、29第六讲 分子的构型与物质的性质一、学习目标:1、能根据杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型。2、了解“等电子原理”的含义,能结合实例说明“等电子原理”的应用。3、了解简单配合物的成键情况(配合物的空间构型和中心原子的杂化类型不作要求)二、教学内容:一、分子的空间构型:1、多原子分子(离子)的立体结构化学式中心原子孤对电子对数杂化轨道数杂化轨道类型分子结构CH404sp3正四面体C2H403sp2平面三角形BF303sp2平面三角形CH2O03sp2平面三角形C2H202sp直线型CO202sp直线型NH314sp3三角锥形NH4+04sp3正四面体H2O24sp3V 形H3O+14sp3三角锥形2.价层电子对互斥模型判断简单分子或离子的空间构型电子对数 目电子对的空间构型成键电子对数孤电子对 数电子对的排列方式分子的空间构型实 例2直 线20直 线CO2、C2H23三角形30三角形BF3、SO321V—形SnCl2、PbCl24四面体40四面体CH4、SO42-CCl4、NH4+31三角锥NH3、PCl322V—形H2O、H2S3.等电子原理及其应用2009 级高一化学竞赛辅导材料[物质结构与性质]2010、4、29等电子体:原子数相同,价电子数也相同的微粒,如:CO 和 N2,CH4和 NH4+;等电子体具有相似的化学键特征,性质相似。4.简单配合物 (1)配位键:一个原子提供一对电子与另一个接受电子的原子形成的共价键.即成键的两个原子一方提供孤对电子,一方提供空轨道而形成的共价键.(2)①.配合物:由提供孤电子对的配位体与接受孤电子对的中心原子(或离子)以配位键形成的化合物称配合物,又称络合物.② 形成条件:a.中心原子(或离子)必须存在空轨道. b.配位体具有提供孤电子对的原子③ 配合物的组成①中心原子——配合物的中心。常见的是过渡金属的原子或离子,如: (也可以是主族元素阳离子,如: ) ②配位体——指配合物中与中心原子结合的离子或分子。内界 常见的有:阴离子,如: 中心分子,如: (配位原子——指配合物中直接与中心原子相联结的配位体中的原子,它含有孤电子对)③配位数——配位体的数目④ 配合物的性质:配合物具有一定的稳定性.配合物中配位键越强,配合物越稳定.当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关.1 、 Co(NH3)5BrSO4 可 形 成 两 种 钴 的 配 合 物 . 已 知 两 种 配 合 物 的 分 子 式 分 别 为[Co(NH3)5Br] SO4 和[Co (SO4) (NH3)5] Br...