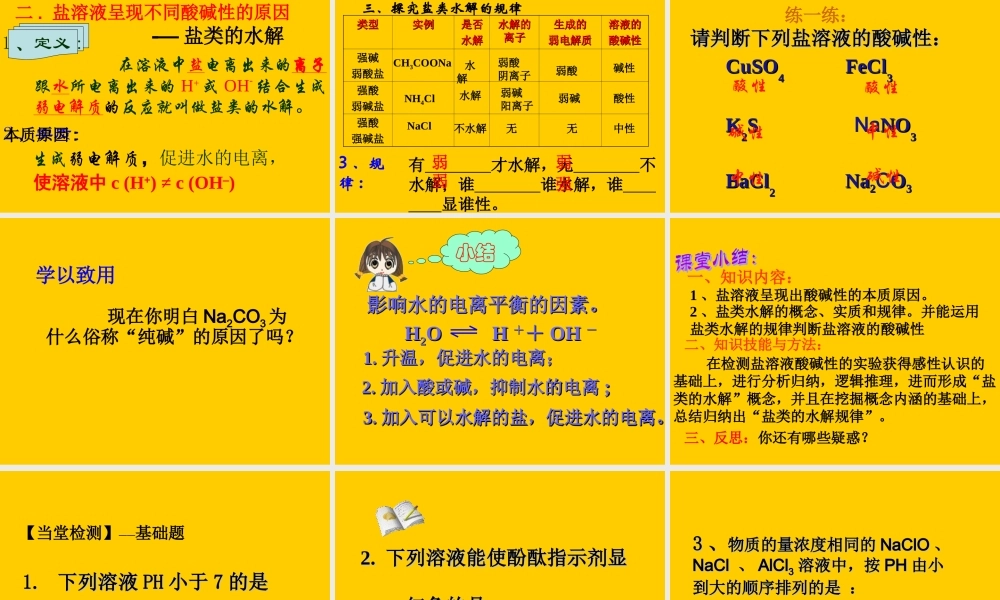
第三章 水溶液中的离子平衡第三节 盐类的水解 ( 第一课时 )枣阳市白水高中 高锦元【学习目标】1 、知识与能力:( 1 )理解强酸弱碱盐和强碱弱酸盐的水解( 2 )能运用盐类水解的规律判断盐溶液的酸碱性 2 、过程与方法:( 1 )培养分析问题的能力,能透过现象看本质。( 2 )由实验中各种盐溶液的 pH 的不同,通过比较、分类、归纳、概括等方法分析其原因,进而找出盐类水解的规律 。3 、情感、态度与价值观: 通过实验培养实验技能和严谨的科学态度,知道科学研究的一般方法。【学习重点难点】重点:不同盐溶液呈现不同酸碱性的本质原因。难点:对化学平衡、电离平衡以及水的离子积等知识的综合运用。[ 知识回顾 ]一、影响水的电离平衡的因素有哪些?这些因素对水的离子积 KW 有无影响?升温:促进水的电离, 升温:促进水的电离, KKWW 增大增大HH22O HO H++ + OH + OH-- HH22O HO H++ + OH + OH-- (正反应吸热)(正反应吸热)(正反应吸热)(正反应吸热)加入酸或碱:抑制水的电离, 加入酸或碱:抑制水的电离, KKW 不变不变[ 知识回顾 ]二、溶液的酸碱性酸性溶液: c ( H+ ) > c ( OH— ) 中性溶液: c ( H+ ) = c ( OH— ) 碱性溶液: c ( H+ ) < c ( OH— ) 纯碱的成分是什么? 它是碱吗 ? 你想知道为什么会这样称呼它吗? 问题导入探究实验:分别测出下列物质的 pH 值物质pH 值酸碱性物质pH 值酸碱性=7<7>7<7=7>7碱性碱性酸性酸性中性中性一一 .. 探究盐溶液的酸碱性探究盐溶液的酸碱性::CH3COONaNaHCO3NH4ClNaClKNO3Al2(SO4)3 结论 : 盐溶液不一定都是中性 , 有的呈酸性 , 有的呈碱性。测试对象生成该盐的盐的 类型溶液酸碱性酸碱CH3COONa NaHCO3NH4Cl Al2(SO4)3NaCl KNO3一一 .. 探究盐的组成与盐溶液的酸碱性的规探究盐的组成与盐溶液的酸碱性的规律律::碱性酸性中性HClNH3 · H2OH2SO4Al(OH)3HClNaOHHNO3KOH强碱弱酸盐强酸弱碱盐强碱强酸盐CH3COOHNaOH H2CO3 NaOH [ 思考与交流 2] 水电离产生的 C(H+)=C(OH-) 。大多数盐溶于水,既不会电离出 H+ ,也不会电离出 OH- ,为什么盐溶液也会显示出酸碱性?二、探究盐溶液呈现不同酸碱性的原因提示:提示:请大家交流如下问题请大家交流如下问题 (( 11 )把盐溶于水之后,溶液中存在哪几种)把盐溶于水之后,溶液中存在哪几种电离? 电离...