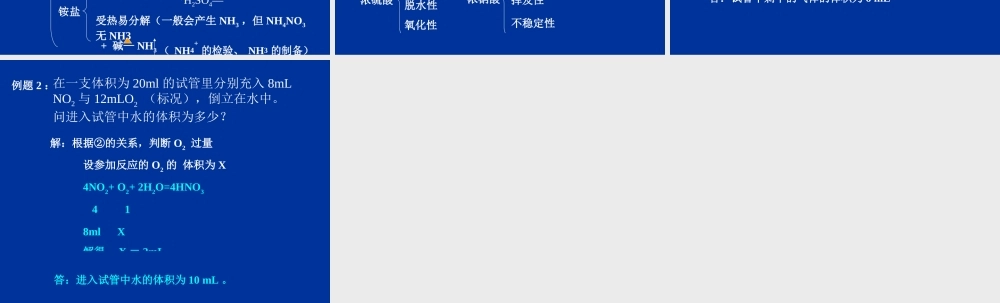
第四章 非金属及其化合物(复习)一、硅1 、硅单质2 、二氧化硅结构:性质:用途:物理性质:黑色,金属光泽,硬而 脆,熔、沸点高的固体。化学性质Si + 2F2 = SiF4Si + 4HF = SiF4 +2H2Si + 2NaOH +2 H2O= Na2SiO3+ 2H2Si + 2Cl2 === SiCl4高温存在:存在:结构:性质:用途:物理性质:化学性质SiO2+ 4HF =SiF4 + H2O SiO2+2 NaOH=Na2SiO3+ H2OSiO2+CaO==CaSiO3SiO2+2C==Si+2CO高温高温3 、硅酸制备: 可溶性的硅酸盐与酸的反应如: Na2SiO3+ 2HCl=2NaCl+H2SiO3化学性质:脱水:H2SiO3= SiO2 +H2O弱酸性:酸性比碳酸还弱Na2SiO3+ H2O +CO2=Na2CO3 +H2SiO3用途:4 、硅酸盐水玻璃: Na2SiO3 的水溶液,具有防火作用普通玻璃、陶瓷、水泥的主要成分都是硅酸盐无机非金属材料传统无机非金属材料:(硅酸盐材料)新型无机非金属材料玻璃、陶瓷、水泥新型陶瓷光导纤维二、氯(卤素)氯气的性质 ( 制备 )物理性质 黄绿色有刺激性气味的有毒气体化学性质与金属反应Na + Cl2—Cu+ Cl2 —Fe + Cl2 —与非金属反应 Cl2+H2—Cl2+P —与水反应 :Cl2+H2O=HCl +HClO与碱反应Cl2+NaOH Cl2+Ca(OH)2 用途Cl- 的检验试剂:AgNO3 溶液。稀硝酸溶液操作及现象:先加 AgNO3 溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解离子反应Ag+ + Cl- = AgCl思考 1 :氯水的成分有哪些 ?思考 2 : HClO 有哪些性质?(漂白性、弱酸性、不稳定性) 2HClO == 2HCl + O2 光思考 3 :漂白粉和漂白液有哪些用途? 三、二氧化硫生成: S + O2 == SO2 点燃性质物理性质:无色有刺激性气味的有毒易溶于水的气体。化学性质:水溶液有酸性 能使酸碱指示剂变色与碱性氧化物反应与碱反应还原性2SO2+O2 = 2SO3 氧化性:SO2 + Cl2+ 2H2O=H2SO4+2HClSO2+ 2H2S== 3S + 2H2O漂白性 能与有色物质结合生成不稳定的无色物质催化剂四、氮NO :NO2 :NH3铵盐无色有毒难溶的气体。 2NO+O2=2NO2红棕色有刺激性气味的有毒气体,可溶于水3NO2+H2O= 2HNO3 +NO①NO 和 O2 混合溶于水 : 4NO +3O2+ 2H2O =4HNO3②NO2 和 O2 混合溶于水 : 4NO2+ O2 +2H2O = 4HNO3 ③NO2 、 NO 和 O2 混合溶于水 NO2+NO+O2 +H2O=2HNO3 物理性质 :无色有刺激性气味的气体,极易溶于水,易液化。化学性质NH3+ H2O—NH3 +HCl—HNO3—H2SO4—晶体受热易分解(一般会产生 NH3 ,但 NH4NO3...