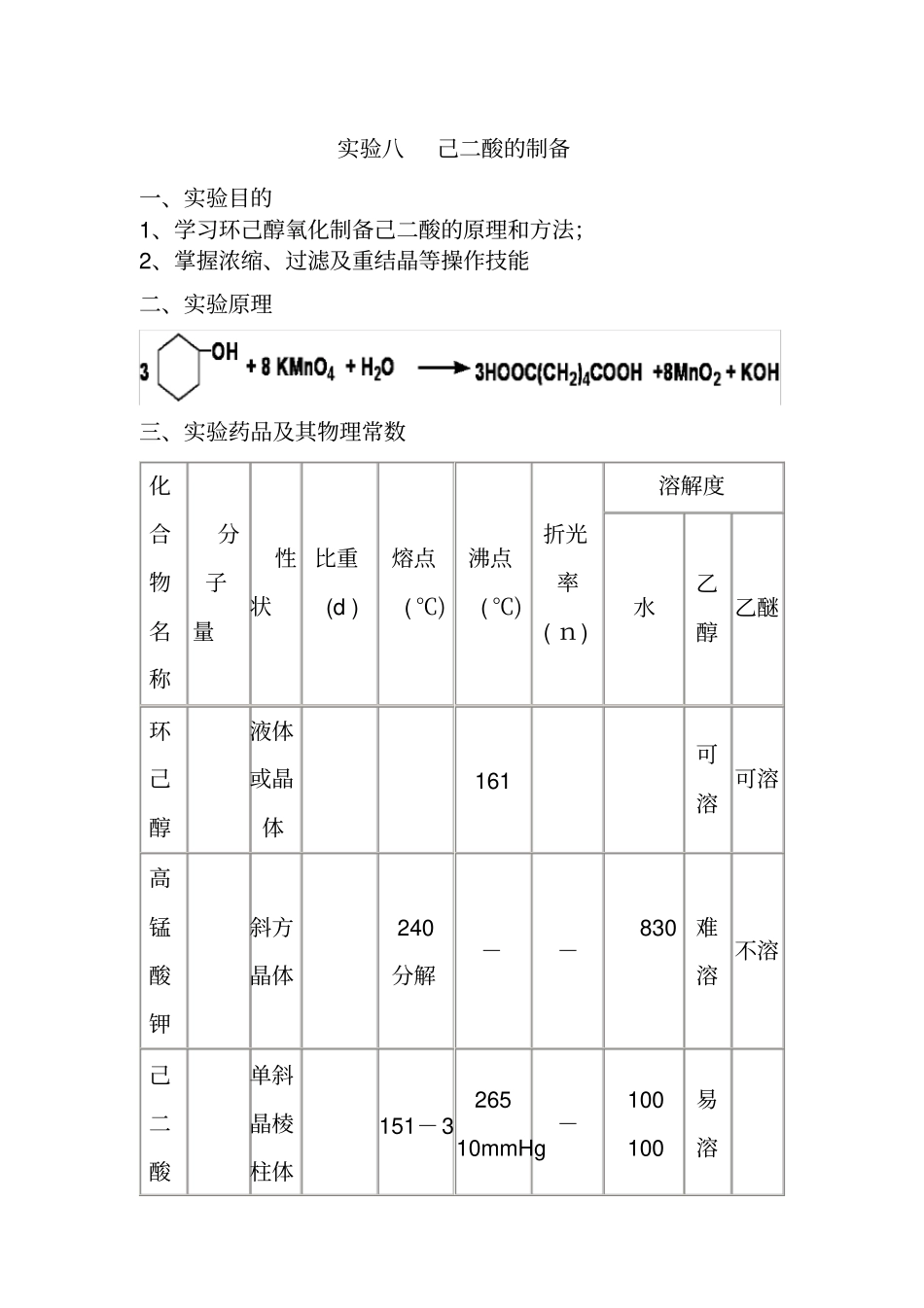
实验八己二酸的制备一、实验目的1、学习环己醇氧化制备己二酸的原理和方法;2、掌握浓缩、过滤及重结晶等操作技能二、实验原理三、实验药品及其物理常数化合物名称分子量性状比重(d )熔点( ℃)沸点( ℃)折光率( n)溶解度水乙醇乙醚环己醇液体或晶体161可溶可溶高锰酸钾斜方晶体240分解--830难溶不溶己二酸单斜晶棱柱体151-326510mmHg-100100易溶环己醇: 2g ;高锰酸钾6g ;氢氧化钠溶液 50ml ;亚硫酸氢钠;浓盐酸四、主要仪器和材料水浴锅三口烧瓶 (100 mL 、19#×3) 恒压滴液漏斗空心塞 (14#) 球形冷凝管 (19#) 螺帽接头 (19# ,2 只) 温度计(100℃) 布氏漏斗吸滤瓶烧杯冰 滤纸水泵等 .氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。本实验采用碱性高锰酸钾作氧化剂五、实验装置六、操作步骤(1)向 250ml 烧杯内加入50ml 氢氧化钠溶液,置于磁力搅拌上;(2)边搅拌边将6g 高锰酸钾溶解到氢氧化钠溶液中;(3)用滴管滴加环己醇到上述溶液中,维持反应物温度为 43~47 ℃。(4)当醇滴加完毕且反应混合物温度降低至43 ℃左右时,沸水浴将混合物加热,使二氧化锰凝聚。(5)在一张平整的滤纸上点一小滴混合物以试验反应是否完成,如果观察到试液的紫色存在,那么可以用少量固体亚硫酸氢钠来除掉过量的高锰酸钾。(6)趁热抽滤,滤渣二氧化锰用少量热水洗涤3 次( 每次 2 mL) ,每次尽量挤压掉滤渣中的水分;(7) 合并滤液和洗涤液,用4ml 浓盐酸酸化至;(8) 小心地加热蒸发使溶液的体积减少到10ml 左右,冷却,分离析出的己二酸。(9) 抽滤、洗涤、烘干、称重、计算产率。(10)测量产品的熔点和红外光谱,并与标准光谱比较。【操作要点及注意事项】要研细 , 以利于 KMnO4充分反应。2. 滴加: 本实验为强烈放热反应,所以滴加环己醇的速度不宜过快( 1-2 滴/ 秒),否则,因反应强烈放热,使温度急剧升高而引起爆炸。3. 严格控制反应温度, 稳定在 43~47℃之间。4. 反应终点的判断: (1)反应温度降至43℃以下。 (2)用玻璃棒蘸一滴混合物点在平铺的滤纸上, 若无紫色存在表明已没有KMnO4。5. 用热水洗涤MnO2滤饼时 , 每次加水量约5~10 ml ,不可太多。6. 用浓盐酸酸化时,要慢慢滴加,酸化至pH= 1~3。7. 浓缩蒸发时 , 加热不要过猛 , 以防液体外溅。浓缩至10 ml左右后停止加热,让其自然冷却、结晶。8. 环己醇常温下为粘稠液体,可加入适量水搅拌,便于用滴...