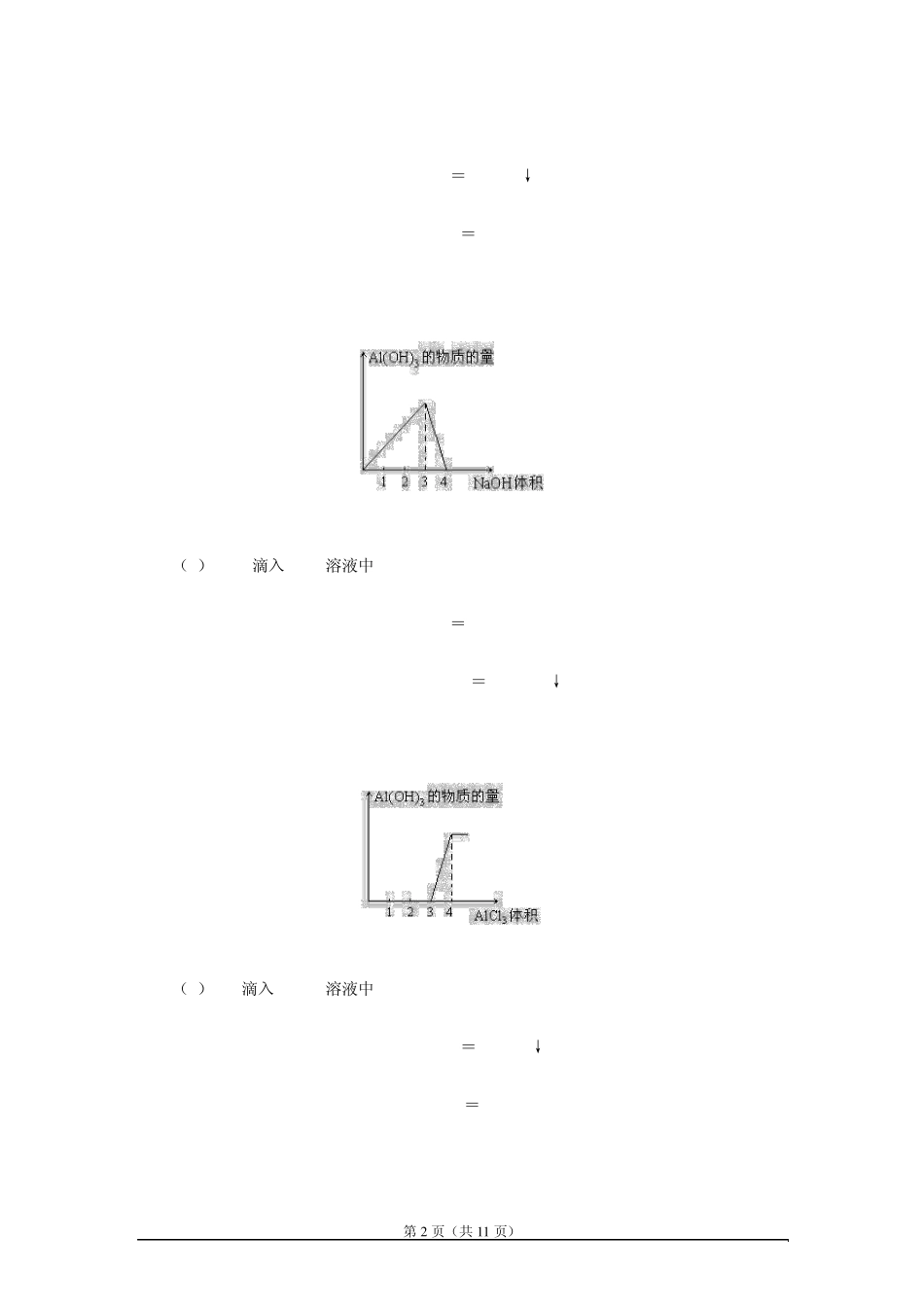
第1 页(共1 1 页) 生成Al(OH)3图象及计算 重点内容讲解: 四、生成Al(OH)3的图象 (1)NH3·H2O滴入 AlCl3溶液中 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (2)CO2通入 NaAlO2溶液中 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- (CO2不足) 或 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (CO2过量) (3)NaOH滴入 AlCl3溶液中 第2 页(共1 1 页) Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O (4)AlCl3滴入 NaOH溶液中 Al3++4OH-=AlO2-+2H2O 3AlO2-+Al3++6H2O=4Al(OH)3↓ (5)HCl滴入 NaAlO2溶液中 AlO2-+H++H2O=Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O 第3 页(共1 1 页) (6)NaAlO2溶液滴入HCl中 AlO2-+4H+=Al3++2H2O Al3++3AlO2-+6H2O=4Al(OH)3↓ 五、离子共存及鉴别 1.离子共存: a.Al3+只存在于酸性溶液中,在碱性溶液中不存在。 例:Al3+与 OH-不能共存; Al3+与某些显碱性的强碱弱酸盐也不能共存,如 Al3+与 AlO、CO、HCO、S2-等不能共存。 第4 页(共1 1 页) b.AlO只存在于碱性溶液中,在酸性溶液中不能共存。 ∴AlO与 H+不能共存; AlO与某些盐的离子也不能共存,如 AlO与 Al3+、NH等不能共存。 2.离子鉴别: Al3+鉴别: 加入 NaOH溶液,产生白色沉淀,加入过量 NaOH,白色沉淀消失,即证明原溶液中含 Al3+。 AlO鉴别: 加入 HCl,产生白色沉淀,加入过量 HCl,白色沉淀消失,即证明原溶液中含 AlO。 例题分析: 1、把 x溶液(或气体)慢慢加入(或通入)到一定量的 y溶液中,产生的沉淀量与加入 x物质的量的关系如图所示,符合图中曲线的是( ) 第5 页(共1 1 页) A、x为CO2,y为Ca(OH)2 B、x为NH3·H2O,y为AlCl3 C、x为NaOH,y为AlCl3 D、x为HCl,y为NaAlO2 答案:D 分析: CO2通入 Ca(OH)2溶液中可产生碳酸钙沉淀,继续通 CO2沉淀溶解而生成 Ca(HCO3)2溶液。氨水加入 AlCl3溶液产生沉淀,但过量不溶,离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ NaOH溶液滴加到 AlCl3溶液中生成 Al(OH)3沉淀,继续加入沉淀溶解生成偏铝酸盐。 AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O 盐酸加入到 NaAlO2溶液中,先生成 Al(OH)3沉淀,继续加入沉淀溶解生成三价铝盐。 HCl+NaAlO2+H2O=Al(OH)3↓+NaCl Al(OH)3+3HCl=AlCl3+3H2O 观察化学方程式的系数,从定量角度分析,只有(D)答案符合题意。 第6 页(共1 1 页) 2、无色透明...