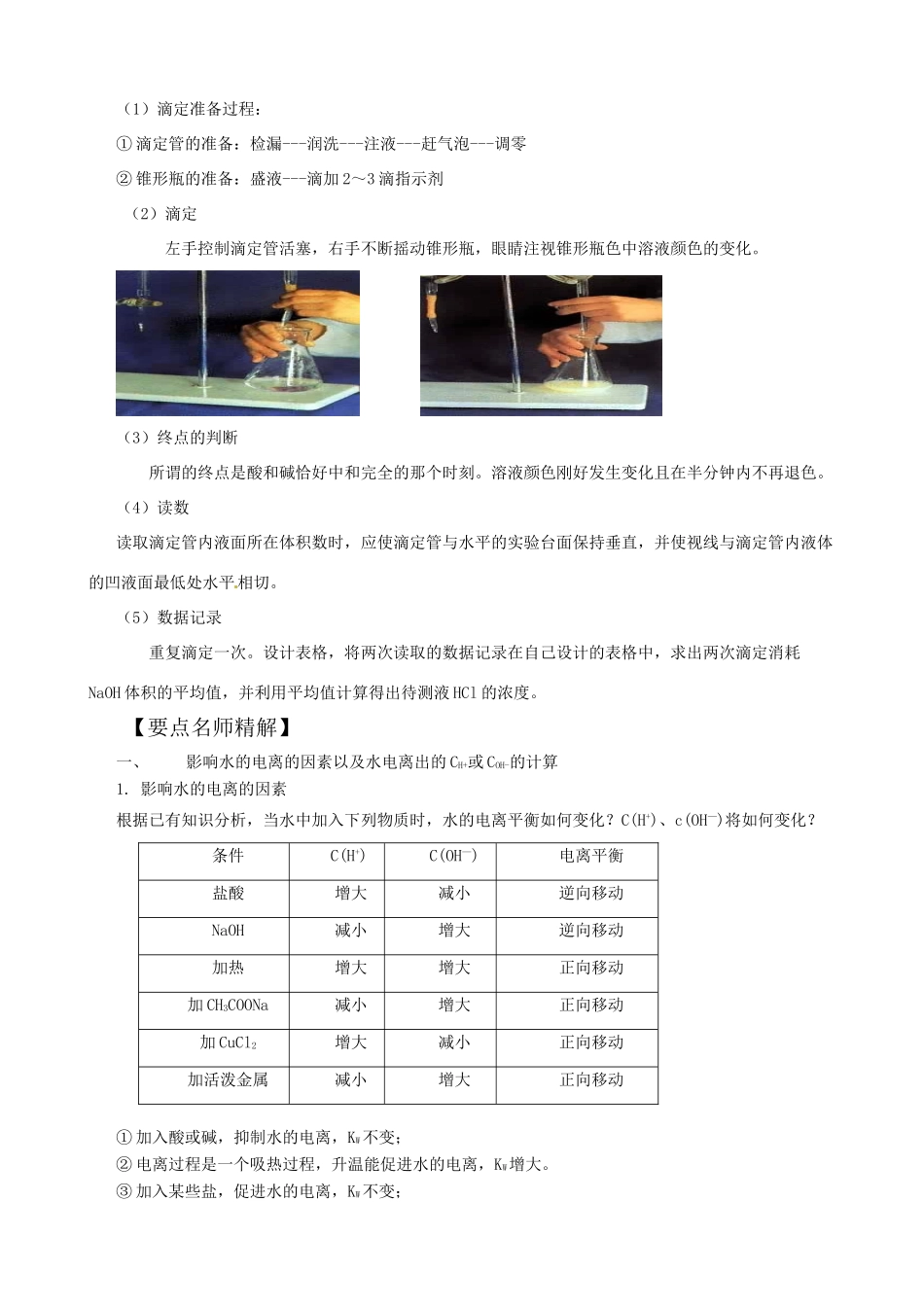
第二节 水的电离和溶液的酸碱性【高考目标定位】考纲导引考点梳理1.了解水的电离、离子积常数2.了解溶液 pH 的定义3.了解测定溶液 pH 的方法。能进行 pH 的简单计算4.能根据实验试题要求,分析或处理实验数据,得出合理结论。1. 水的电离2. 溶液的酸碱性与 pH3. 酸碱中和滴定。【考纲知识梳理】一、水的电离1.水是一种极弱的电解质,只能微弱的电离,存在电离平衡。水的电离方程式:H2O + H2OH3O+ + OH—简写为:H2OH+ + OH— 2.纯水的有关数据:25℃时(1) CH+ = COH-=1×10-7mol/L(2)KW= CH+ ·COH-=1×10-7×1×10-7=1×10-14。(3)PH=73. 水的离子积常数反映了一定温度下的水的 H+ 浓度和 OH- 浓度之间的关系。升高温度,水的电离平衡正向移动,KW增大.水的离子积是水电离平衡时的性质,它是一个温度函数,与溶质无关,它不仅适用于纯水,也适用于任何酸、碱、盐稀溶液,即溶液中,25℃,CH+ ·COH-=1×10-14。注意:若不特别指明,温度都指室温 25℃。在酸溶液中,CH+近似看成是酸电离出来的 H+浓度,COH-则来自于水的电离,且 COH-= 1×10-14/ CH+。在碱溶液中,COH-近似看成是碱电离出来的 OH—浓度,CH+则是来自于水的电离,且 CH+=1×10-14/ COH- 。 温度能影响水的电离平衡,那么还有那些因素会影响水的电离平衡呢?二、溶液的 pH(1)表示方法: pH= -lgCH+(2)25℃,纯水的 pH 为 7,溶液显中性,pH<7 的溶液为酸性,pH>7 的溶液为碱性。注意:pH 为 7 的溶液不一定为中性。100℃,KW=1×10-12,CH+ = COH-=1×10-6mol/L,此时 pH 为 6,但溶液仍为中性。判断溶液酸碱性的依据是比较溶液中 CH+、COH-的相对大小。三、酸碱中和滴定实验 1.试剂:HCl 溶液(未知浓度)、0.1000mol/LNaOH 溶液、酚酞溶液、蒸馏水。 2.仪器:酸式滴定管、碱式滴定管、滴定管夹、锥形瓶、洗瓶、铁架台、烧杯等。 3.实验操作过程:(1)滴定准备过程:① 滴定管的准备:检漏---润洗---注液---赶气泡---调零② 锥形瓶的准备:盛液---滴加 2~3 滴指示剂 (2)滴定 左手控制滴定管活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶色中溶液颜色的变化。 (3)终点的判断 所谓的终点是酸和碱恰好中和完全的那个时刻。溶液颜色刚好发生变化且在半分钟内不再退色。(4)读数读取滴定管内液面所在体积数时,应使滴定管与水平的实验台面保持垂直,并使视线与滴定管内液体的凹液面最低处水平相切...