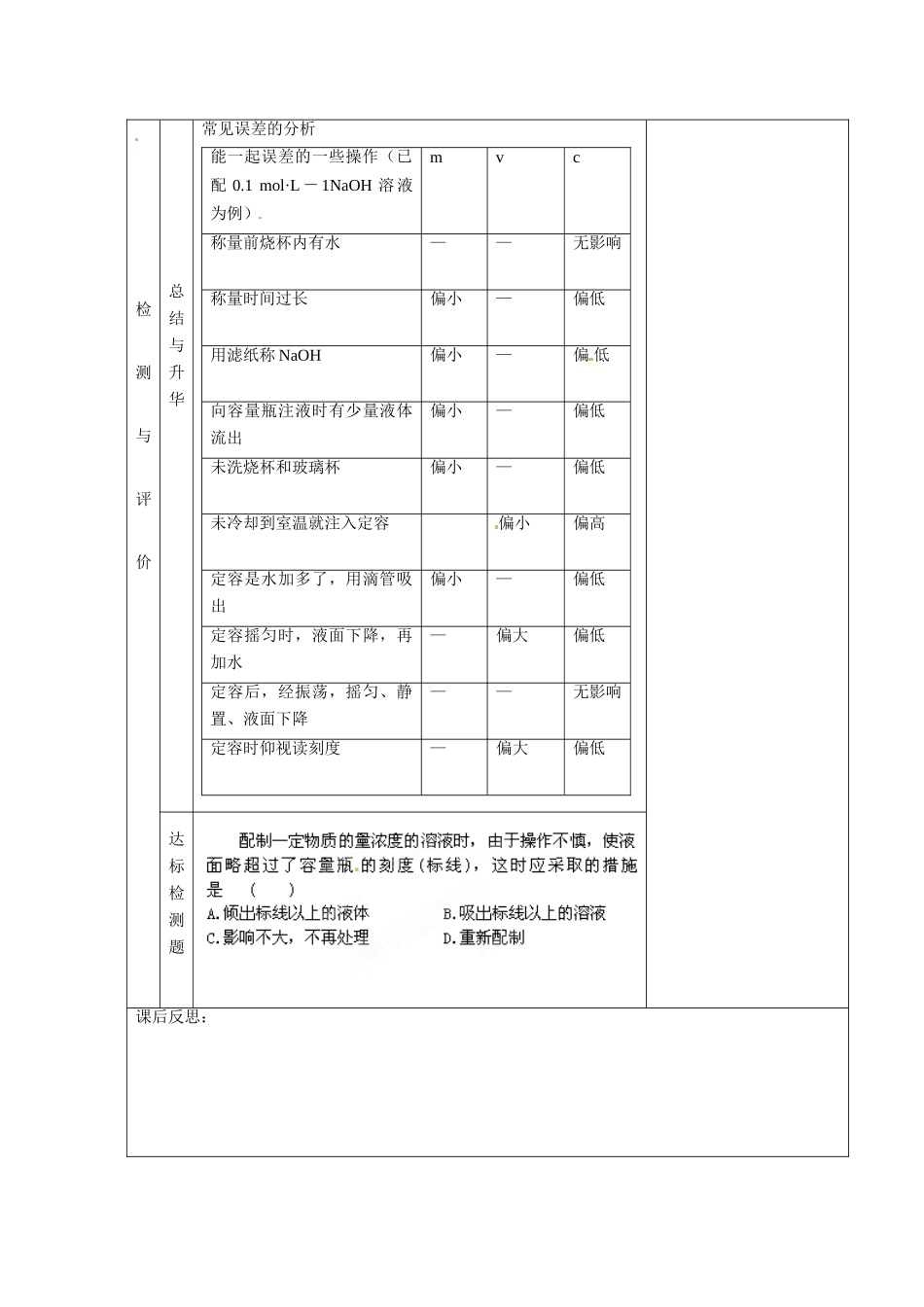
甘肃省金昌市第一中学 2014 高中化学 第一章物质的量在实验中的应用导学案 8 新人教版必修 1学习目标1.了解物质的量浓度的溶液配制的基本原理,初步学会配制一定物质的量浓度溶液的方法和技能。学会容量瓶的使用方法2.培养学生的动手能力和基本实验技能。3.通过实验培养学生学习化学的兴趣和严谨的学习态度。学习重点物质的量浓度的溶液的配制学习难点正确配制一定物质的量浓度的溶液学生活动教学设计自主研讨目标与导入 在配制溶液中哪些操作可能引起溶液浓度的误差? 合 作互动互动与展示配制 0.25 mol·L-1 的 NaOH 溶液 100 mL, 某学生操作如下:①用托盘天平 称出 1.00 g 氢氧化钠:将天平调好零点,再在两盘上各放一张同 样质量的纸,把游码调到1.00g 的位置上,于左盘放粒状氢氧化钠至天 平平衡,取下 称好的氢氧化钠,并撤掉两盘上的纸。②把称好的氢氧化钠放入一只 100 mL 的烧杯中,加入约 10mL 水,搅拌使之溶解, 溶解后立即用玻璃棒引流将溶液移至一只 100 mL 的容量瓶内,加水至离刻度线约 2cm 处,用滴管加水至刻度线。③写出一个标有配制日期的“0.25 mol·L-1NaOH 溶液”的标签,贴在容量瓶上密闭保存。指出上述操作中的 7 处错误:精讲与点拨一、俯视或仰视刻度线对溶液浓度的影响俯视刻度线,实际加水量未到刻度线,使溶液的体积偏小,物质的量浓度增大; 仰视刻度线,实际加水量超过刻度线 ,使溶液的体积偏大,物质的量浓度减小。 二、容量瓶的使用六忌 一忌用容量瓶进行溶解(体积不准确) 二忌直接往容量瓶倒液(洒到外面) 三忌加水超过刻度线(浓度偏低) 四忌读数仰视或俯视(仰视浓度偏低, 俯视浓度偏高) 五忌不洗涤玻璃棒和烧杯(浓度偏低)六忌标准液存放于容量瓶(容量瓶是量器,不是容器) 检测与评价总结与升华常见误差的分析能一起误差的一些操作(已配 0.1 mol·L - 1NaOH 溶 液为例)mvc称量前烧杯内有水——无影响称量时间过长偏小—偏低用滤纸称 NaOH偏小—偏 低向容量瓶注液时有少量液体流出偏小—偏低未洗烧杯和玻璃杯偏小—偏低未冷却到室温就注入定容偏小偏高定容是水加多了,用滴管吸出偏小—偏低定容摇匀时,液面下降,再加水—偏大偏低定容后,经振荡,摇匀、静置、液面下降——无影响定容时仰视读刻度—偏大偏低达标检测题 课后反思: