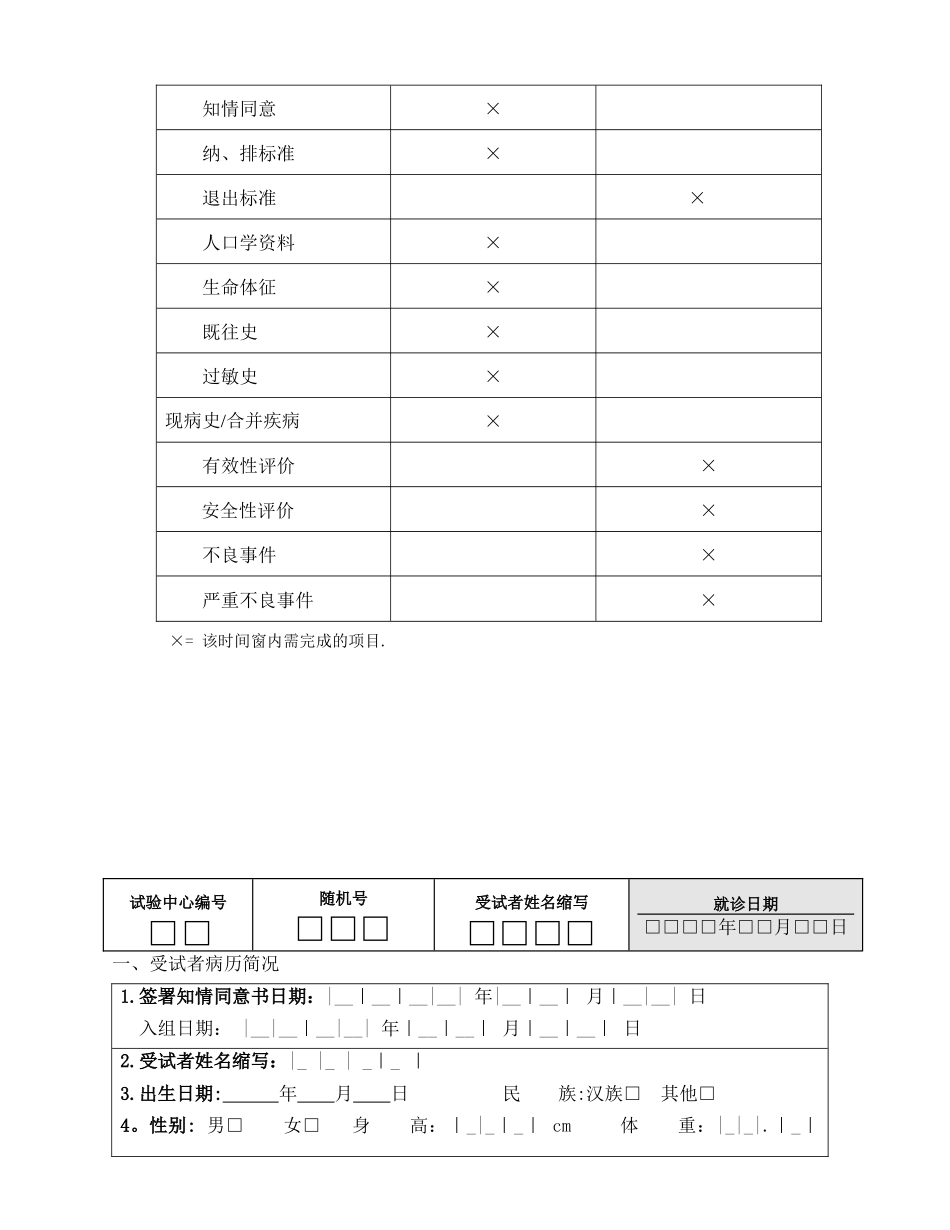
肺功能仪有效性和安全性临床试验讨论病历试验用医疗器械编号:□01 肺功能仪(型号规格:MSPFT—B)□02 肺功能仪(型号规格:MasterScreen) 临床试验机构: □ 河南省人民医院□ 郑州市第六人民医院 版本号和日期:MS202508 2025 年 08 月 06 日 受试者 姓名: 联 系 方 式: 联 系 地 址: 受试者随机号: 讨论者 姓名: 试验开始时间: 年 月 日随访结束日期: 年 月 日申办者:河南迈松医用设备制造有限公司在正式填表前,请仔细阅读下列填写说明讨论病历填写说明1. 参加本试验的讨论者必须经过 GCP 培训,必须事先充分了解本试验方案及有关资料,严格按方案执行。2. 所有筛选者均需填写讨论病历,讨论病历用黑色签字笔填写。3. 病历填写务必准确、清楚,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名及修改时间.举例:58。6 56。8ZS 2025.12。164. 受试者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每一个字的首字母.举例:张红Z HHO李淑明LSM I欧阳小惠OYXH5. 所有选择项目的 □ 内用× 标注.如:。表格中所有栏目均应填写相应的文字或数字,多余空格以“0"填写完整,不得留空。“ND”未查或漏查;“UK”不知道;“NA”不适用。6. 试验期间应如实填写不良事件记录表.记录不良事件的发生时间、严重程度、持续时间、实行的措施和转归。如有严重不良事件(包括临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力等)发生时,必须立即通知临床试验单位临床试验机构伦理委员会及该临床试验的申办者并上报国家食品药品监督管理总局。7. 临床试验应严格根据临床试验方案要求进行。试验不同时期需完成的检查和需记录的项目要根据要求完成。请对比试验流程表执行。严重不良事件报告途径:(发生严重不良事件时需在 24 小时内上报有关单位!) 试验流程图试验流程筛选和入组期检查期时间点项目(0 天-1 天)(第 1 天)申办单位者:河南迈松医用设备制造有限公司电 话:13937728187中心 01临床讨论单位机构办:河南省人民医院国家药物临床试验机构电 话:0371-87160813临床讨论单位伦理委员会:河南省人民医院药物(器械)临床试验伦理委员会电 话:0371—87160817中心 02临床讨论单位机构办:河南省传染病医院(郑州市第六人民医院)电 话:0371-55170252临床讨论单位伦理委员会:...