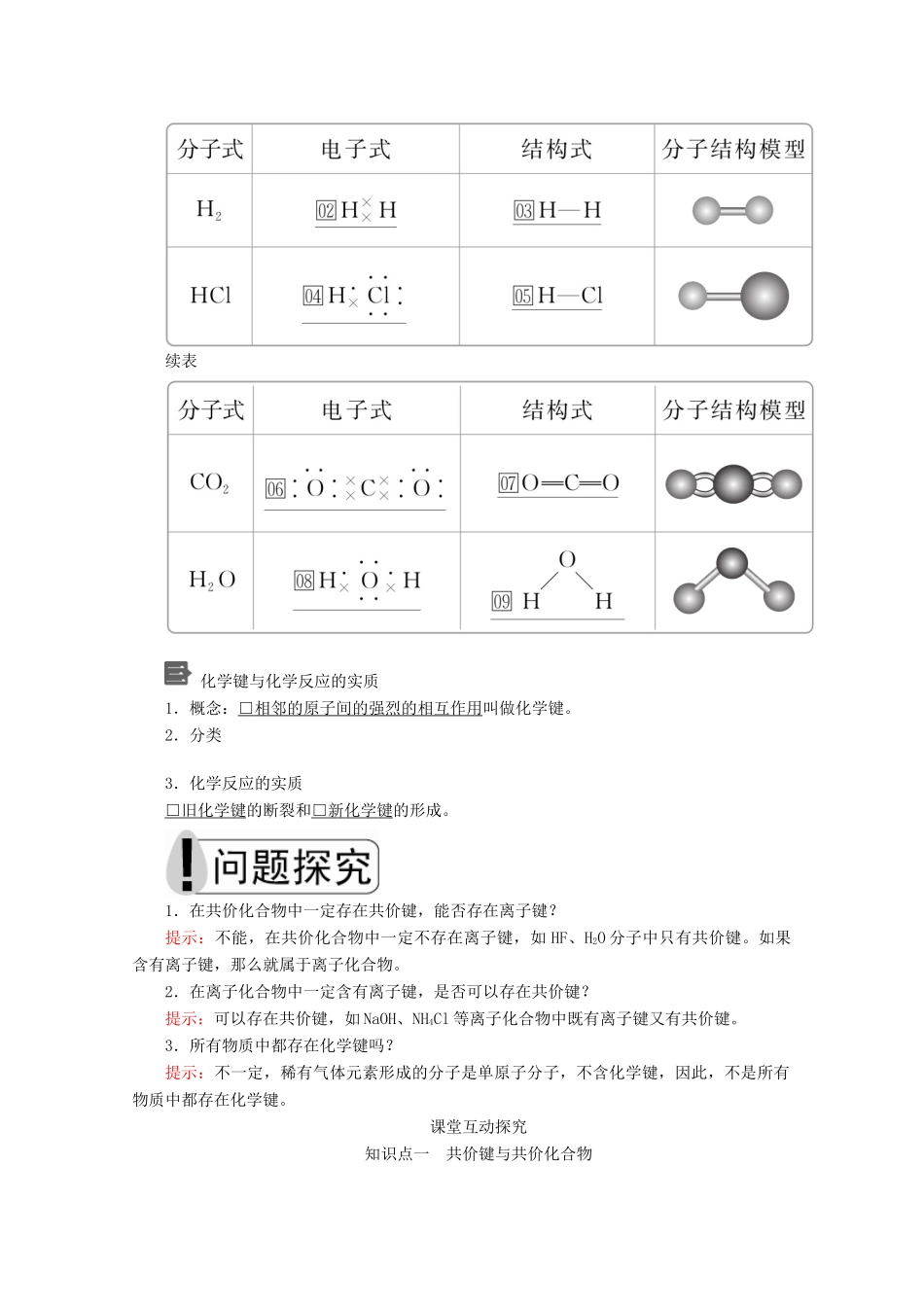
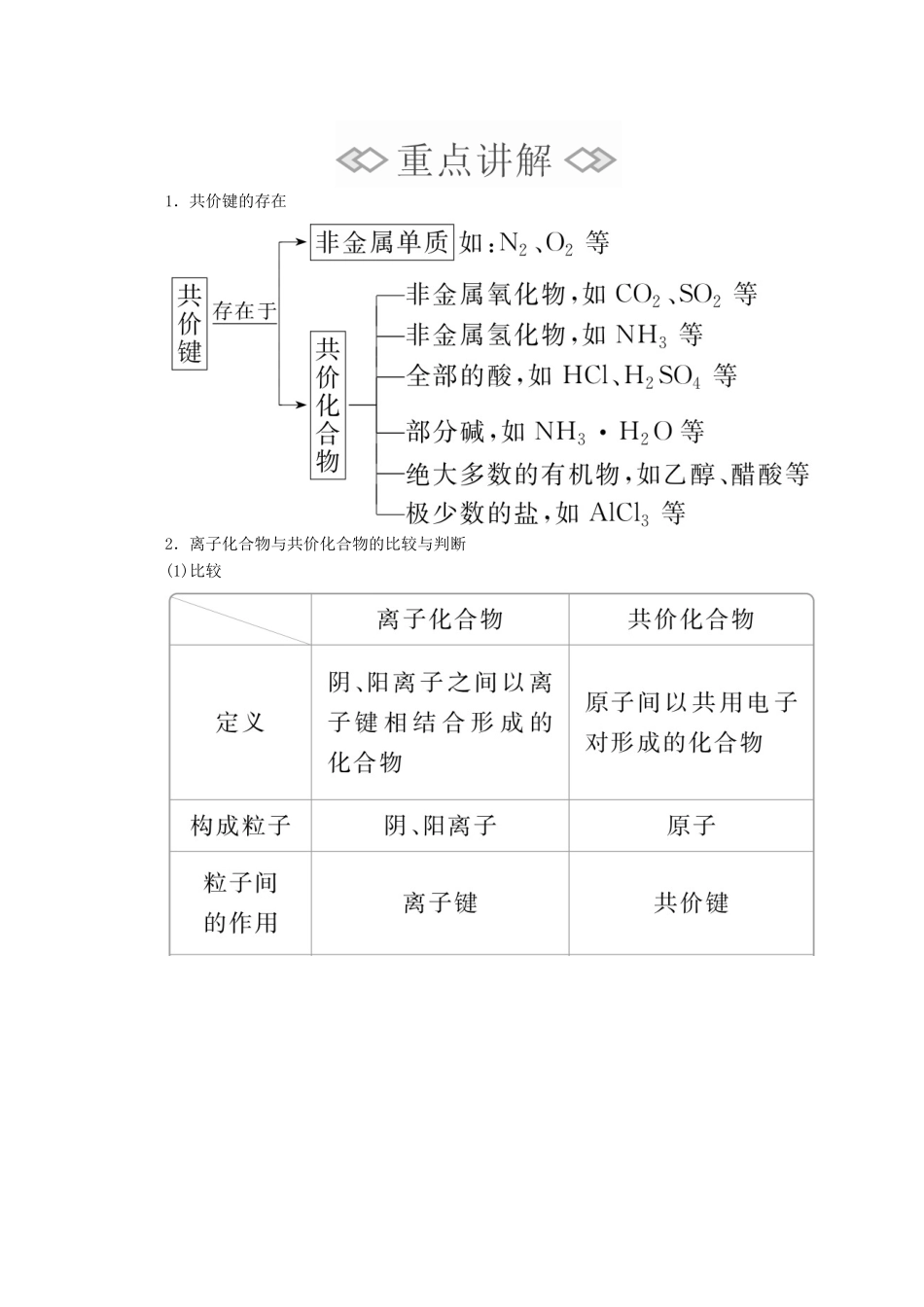
第二课时共价键[明确学习目标]1.知道共价键和共价化合物的概念。2.能用电子式表示简单的共价化合物及形成过程。3.了解化学键的定义,并从化学键角度理解化学反应的实质。学生自主学习共价键和共价化合物1.共价键(1)概念:原子间通过□共用电子对所形成的相互作用。(2)成键三要素①成键微粒:□原子;②成键本质:□共用电子对;③成键元素:一般是同种或不同种□非金属元素。(3)共价键的类型2.共价化合物共价键形成的分子及其结构的表示式1.结构式形成共价键的每一对共用电子用一根短线“—”表示并且略去未成键电子的式子。如Cl2:□Cl—Cl。2.几种常见物质的电子式、结构式及结构模型续表化学键与化学反应的实质1.概念:□相邻的原子间的强烈的相互作用叫做化学键。2.分类3.化学反应的实质□旧化学键的断裂和□新化学键的形成。1.在共价化合物中一定存在共价键,能否存在离子键?提示:不能,在共价化合物中一定不存在离子键,如HF、H2O分子中只有共价键。如果含有离子键,那么就属于离子化合物。2.在离子化合物中一定含有离子键,是否可以存在共价键?提示:可以存在共价键,如NaOH、NH4Cl等离子化合物中既有离子键又有共价键。3.所有物质中都存在化学键吗?提示:不一定,稀有气体元素形成的分子是单原子分子,不含化学键,因此,不是所有物质中都存在化学键。课堂互动探究知识点一共价键与共价化合物1.共价键的存在2.离子化合物与共价化合物的比较与判断(1)比较(2)判断①根据构成物质粒子间的成键类型判断一般来说,活泼的金属原子和活泼的非金属原子间易形成离子键,同种或不同种非金属原子间形成共价键。②根据化合物的类型判断大多数碱性氧化物、强碱和绝大多数盐属于离子化合物;非金属氢化物、非金属氧化物、含氧酸、绝大多数有机化合物属于共价化合物。③根据化合物的性质判断熔融状态下能导电的化合物是离子化合物,不能导电的化合物为共价化合物。1下列反应过程中,同时有离子键、极性共价键和非极性共价键断裂和形成的反应是()A.NH4Cl=====NH3↑+HCl↑B.NH3+CO2+H2O===NH4HCO3C.2NaOH+Cl2===NaCl+NaClO+H2OD.2Na2O2+2CO2===2Na2CO3+O2[批注点拨][解析]A、B两项反应中反应物和生成物中没有非极性共价键,不符合题意;C项,有非极性共价键(Cl—Cl键)的断裂,没有非极性共价键的形成。[答案]D[练1]下列叙述中正确的是()A.完全由金属和非金属元素形成的化合物一定是离子化合物B.完全由非金属元素形成的化合物一定是共价化合物C.离子化合物中只含有离子键D.共价化合物中只含有共价键答案D解析完全由金属元素和非金属元素形成的化合物不一定是离子化合物,如氯化铝(AlCl3)就属于共价化合物,A选项错误;氯化铵(NH4Cl)完全由非金属元素组成,但属于离子化合物,B选项错误;C选项,如NaOH中的OH-内存在着共价键,错误;只以共价键形成的化合物叫做共价化合物,D选项正确。[练2]下列化学反应过程中,同时有离子键、共价键的断裂和形成的是()A.N2+3H2((((2NH3B.2NaCl=====2Na+Cl2↑C.2NaHCO3=====Na2CO3+CO2↑+H2OD.2NaOH+MgCl2===Mg(OH)2↓+2NaCl答案C解析A项,反应物断裂的是N2中的N≡N键和H2中的H—H键,生成的是NH3中的N—H键,都属于共价键,错误;B项,反应物为离子化合物,不存在共价键,错误;C项,反应物在反应中有离子键的断裂(Na+与HCO),又有共价键的断裂(HCO中的共价键),生成物中有离子键的形成(Na+与CO),又有共价键的形成(H2O、CO2),正确;D项,没有共价键的断裂和形成,错误。方法规律(1)离子化合物中一定含有离子键,共价化合物一定不含离子键。(2)离子化合物中可能含有极性共价键(如NaOH),也可能存在非极性共价键(如Na2O2)。(3)只含共价键的物质不一定是共价化合物,可能是非金属单质。(4)非极性键也可以存在于化合物中(如H2O2)。知识点二含共价键物质的电子式及结构式电子式书写常见的“八大错误”(1)漏写孤电子对。如将N2的电子式误写成N⋮⋮N,正确的应为N⋮⋮N。(2)混淆电子式与化学式的书写,如将Na2S的电子式误写成Na[S]2-。(3)共用电子对数目不清,如将CO2的电子式误写成OCO,正确的应为。(4)错误使用...