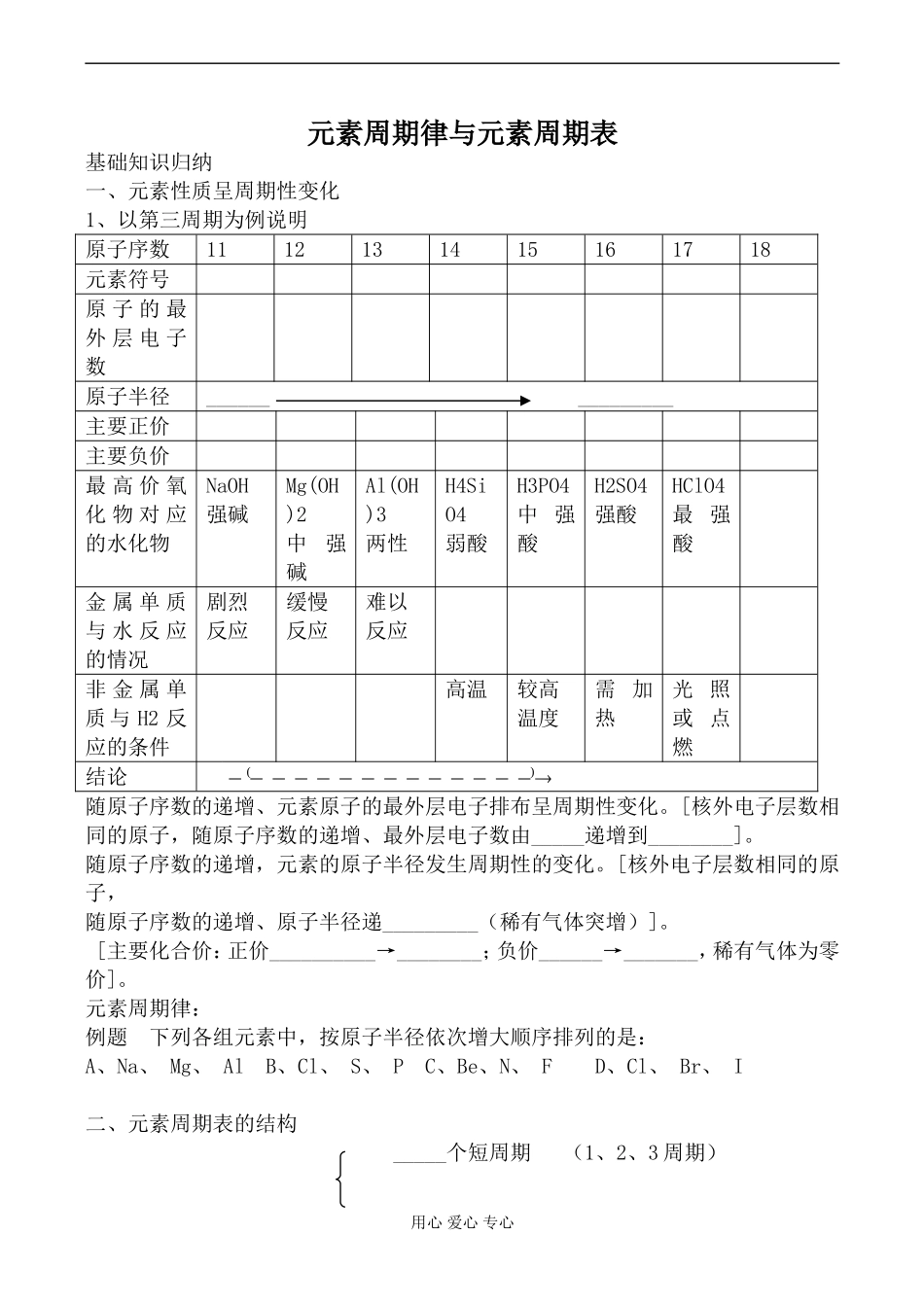
元素周期律与元素周期表基础知识归纳一、元素性质呈周期性变化1、以第三周期为例说明原子序数1112131415161718元素符号原子的最外层电子数原子半径_______________主要正价主要负价最高价氧化物对应的水化物NaOH强碱Mg(OH)2中强碱Al(OH)3两性H4SiO4弱酸H3PO4中强酸H2SO4强酸HClO4最强酸金属单质与水反应的情况剧烈反应缓慢反应难以反应非金属单质与H2反应的条件高温较高温度需加热光照或点燃结论()随原子序数的递增、元素原子的最外层电子排布呈周期性变化。[核外电子层数相同的原子,随原子序数的递增、最外层电子数由_____递增到________]。随原子序数的递增,元素的原子半径发生周期性的变化。[核外电子层数相同的原子,随原子序数的递增、原子半径递_________(稀有气体突增)]。[主要化合价:正价__________→________;负价______→_______,稀有气体为零价]。元素周期律:例题下列各组元素中,按原子半径依次增大顺序排列的是:A、Na、Mg、AlB、Cl、S、PC、Be、N、FD、Cl、Br、I二、元素周期表的结构_____个短周期(1、2、3周期)用心爱心专心周期(__个)_____个长周期(4、5、6周期)_____个不完全周期(7周期)1、元素周期表主族(_____个)IA~VIIA副族(_____个)IB~VIIB族(___个)VIII族(_____个)8、9、10三个纵行零族(_____个)最右边一个纵行(惰性气体元素)归纳:_____主、______副、_____八、______零;______长、_____短、_____不完全。2、元素周期表与原子结构的关系原子序数=_____________数=_____________数=_____________数周期序数=_____________数主族序数=_____________电子数=元素的最高正价数*|最高正价数|+|负价数|=8例题、元素R的最高价含氧酸的化学式为HnRO2n-2,则在气态氢化物中R元素的化合价为多少?3、元素周期表中同周期,则主族元素性质的递变规律项目同周期(从左到右)同主族(从上到下)价电子数(最外层电子数)由____逐渐增到____相同主要化合价最高正价由____→____负价由____→____最高正价相同原子半径逐渐减小(惰性气体除外)逐渐增大金属性与非金属性金属性____非金属性____金属性____强非金属性____最高价氧化物对应水化物的酸碱性碱性____酸性____碱性____酸性____非金属的气态氢化物生成由____到____稳定性由____到____生成由____到____稳定性由____到____得失电子能力失电子由大→小得电子由小→大得电子由大→小失电子由小→大三、元素周期表的应用元素周期表的应用1、预测元素的性质(由递变规律推测)用心爱心专心常见的题目给出一种不常见的主族元素(如砹、碲、铋、铅、铟、镭、铯等),或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质。解答的关键是根据该元素所在族的熟悉的元素的性质,根据递变规律,加以推测判断。按周期表的位置寻找元素启发人们在一定区域内寻找新物质(农药、半导体、催化剂等)。3、启发人们在一定区域内寻找新物质。四、两性氧化物和两性氢氧化物(1)两性氧化物:。例:_____________写出其分别跟盐酸、氢氧化钠反应的方程式(2)两性氢氧化物:的氢氧化物。用心爱心专心