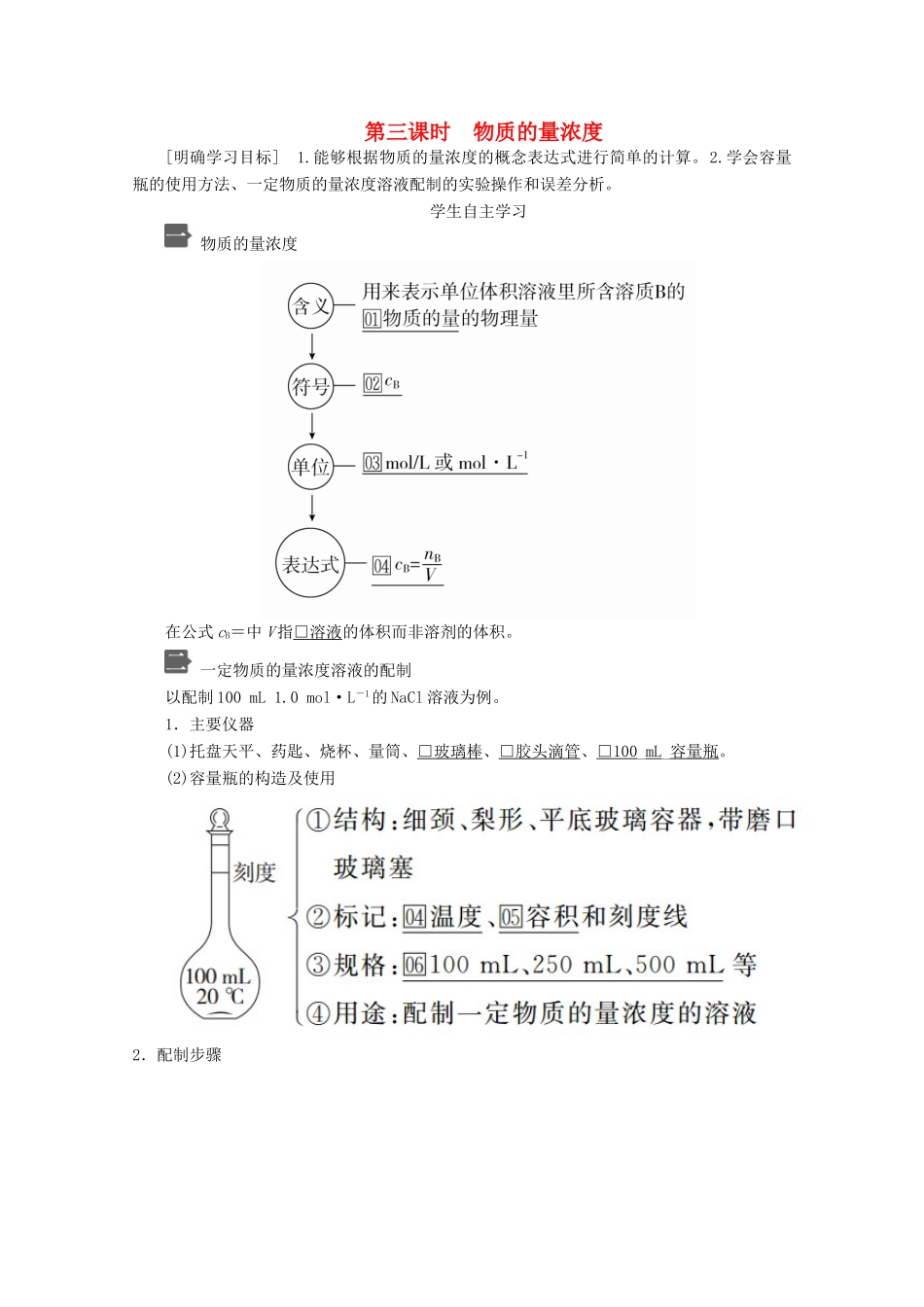
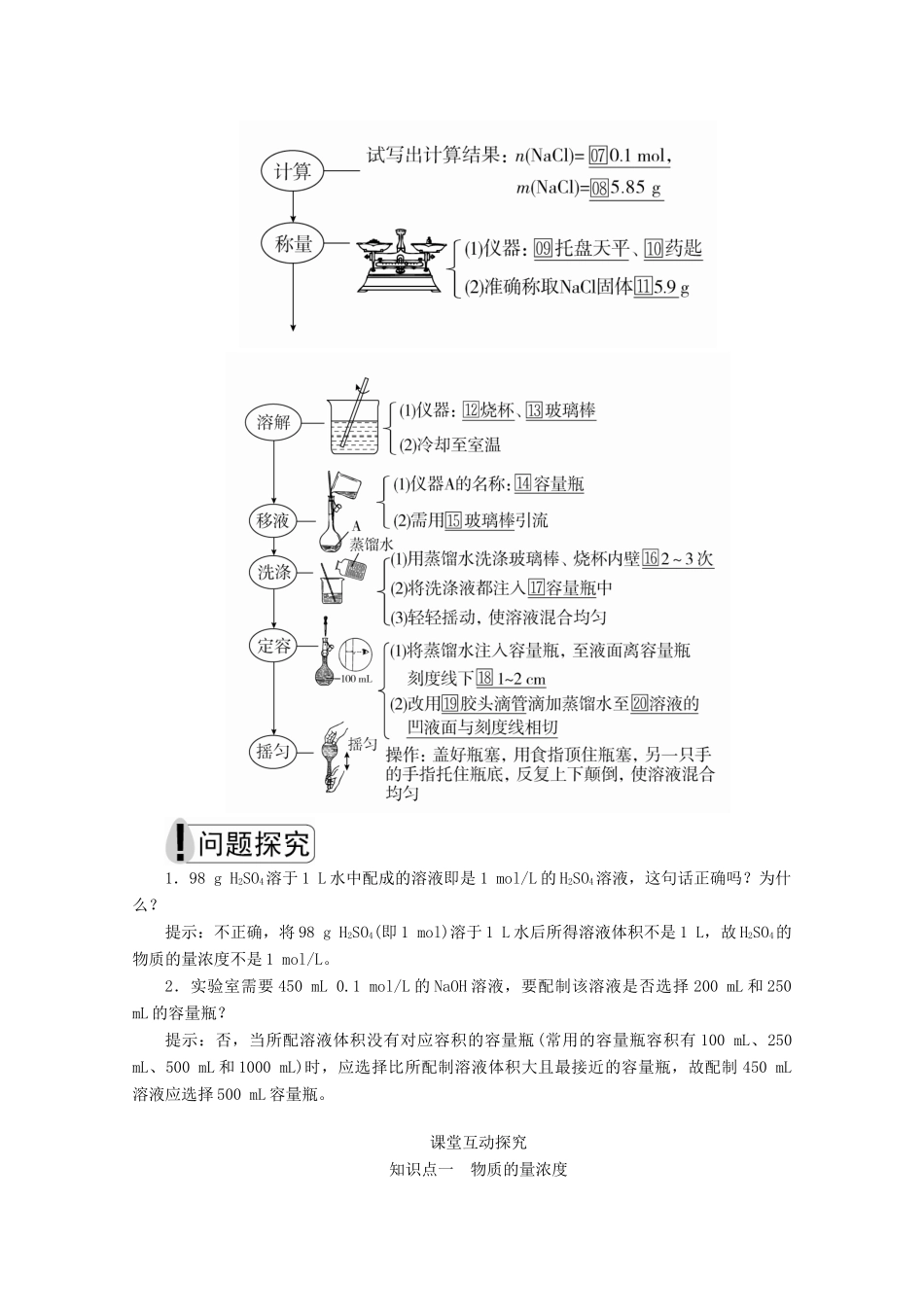
第三课时物质的量浓度[明确学习目标]1.能够根据物质的量浓度的概念表达式进行简单的计算。2.学会容量瓶的使用方法、一定物质的量浓度溶液配制的实验操作和误差分析。学生自主学习物质的量浓度在公式cB=中V指□溶液的体积而非溶剂的体积。一定物质的量浓度溶液的配制以配制100mL1.0mol·L-1的NaCl溶液为例。1.主要仪器(1)托盘天平、药匙、烧杯、量筒、□玻璃棒、□胶头滴管、□100_mL_容量瓶。(2)容量瓶的构造及使用2.配制步骤1.98gH2SO4溶于1L水中配成的溶液即是1mol/L的H2SO4溶液,这句话正确吗?为什么?提示:不正确,将98gH2SO4(即1mol)溶于1L水后所得溶液体积不是1L,故H2SO4的物质的量浓度不是1mol/L。2.实验室需要450mL0.1mol/L的NaOH溶液,要配制该溶液是否选择200mL和250mL的容量瓶?提示:否,当所配溶液体积没有对应容积的容量瓶(常用的容量瓶容积有100mL、250mL、500mL和1000mL)时,应选择比所配制溶液体积大且最接近的容量瓶,故配制450mL溶液应选择500mL容量瓶。课堂互动探究知识点一物质的量浓度一、运用cB的注意事项1.物质的量浓度的概念中的“单位体积”指的是溶液的体积,而不是溶剂的体积。2.溶质B表示任意的溶质,B的组成可以是分子、离子等,也可以是由阴、阳离子构成的结构单元。3.对于一定物质的量浓度的溶液,不论取用多少体积,各份溶液中溶质的物质的量浓度始终不变,只是在不同体积的溶液中,溶质的物质的量不同。例如,1L1mol·L-1的NaCl溶液中,Cl-的物质的量浓度为1mol·L-1,Cl-的物质的量为1mol;从中取出0.5L,该份溶液中Cl-的物质的量浓度仍为1mol·L-1,而Cl-的物质的量变为0.5mol。4.用带有结晶水的物质配制溶液时,在确定溶质的物质的量时,用结晶水合物的质量除以结晶水合物的相对分子质量即可,但溶液中的溶质仍为不带结晶水的物质。二、物质的量浓度的相关计算1.溶液的稀释与混合(1)稀释溶质质量不变:m1w1=m2w2;溶质的物质的量不变:c(浓)·V(浓)=c(稀)·V(稀)。(2)混合c(混)·V(混)=c1V1+c2V2。2.物质的量浓度与溶质质量分数之间的换算cB====;w=。特别注意ρ的单位是g/mL,c的单位为mol/L。3.一定体积的气体(标准状况)溶于水后形成的溶液中溶质的物质的量浓度的计算方法(1)若已知溶液的体积(2)若已知溶液的密度[假定气体的摩尔质量为Mg/mol,VL(标准状况)该气体溶于1L水中所得溶液的密度为ρg/cm3]计算过程:①先计算溶质的物质的量:n=mol;②再计算溶液的体积:V(溶液)==×1×10-3L/cm3=L;③最后计算溶质的物质的量浓度:c===mol/L。1下列说法中正确的是()A.将40gNaOH溶于1L水中,所得溶液的物质的量浓度为1mol·L-1B.从1L1mol·L-1的碳酸钠溶液中取出500mL后,剩余溶液的物质的量浓度为0.5mol·L-1C.将22.4LHCl气体溶于水后配成1L溶液,所得盐酸的浓度为1mol·L-1D.100mL溶液中含有28.4gNa2SO4,则c(Na2SO4)为2.0mol·L-1[批注点拨][解析]A项中NaOH的物质的量为1mol,溶于1L水后所得溶液的体积不等于1L,故所得溶液的物质的量浓度不是1mol·L-1(小于1mol·L-1);B项中溶液的物质的量浓度与溶液的取用量无关,剩余溶液的物质的量浓度仍为1mol·L-1;C项中未指明气体所处的温度和压强,因而22.4LHCl气体的物质的量不一定是1mol;D项,cB===2.0mol·L-1。[答案]D[练1]用40gNaOH固体配成2L溶液,其物质的量浓度为()A.0.5mol·L-1B.5mol·L-1C.10mol·L-1D.20mol·L-1答案A解析NaOH的物质的量为1mol,c(NaOH)==0.5mol·L-1[练2](1)物质的量浓度为2mol·L-1的H2SO4溶液250mL,含H2SO4的物质的量为________。(2)已知75mL2mol·L-1的NaOH溶液的质量为80g,则该溶液中溶质的质量分数为________。答案(1)0.5mol(2)7.5%解析(1)n(H2SO4)=c(H2SO4)·V(H2SO4)=2mol·L-1×250×10-3L=0.5mol。(2)n(NaOH)=2mol·L-1×75×10-3L=0.15mol,m(NaOH)=0.15mol×40g·mol-1=6.0g,w(NaOH)=×100%=7.5%。方法规律(1)进行物质的量浓度的有关计算时,各种情况下最终落脚点是物质的量浓度的定义式c=,要充分利用有关物质的量的各种计算公式,发挥物质的量的桥梁作用。(2...