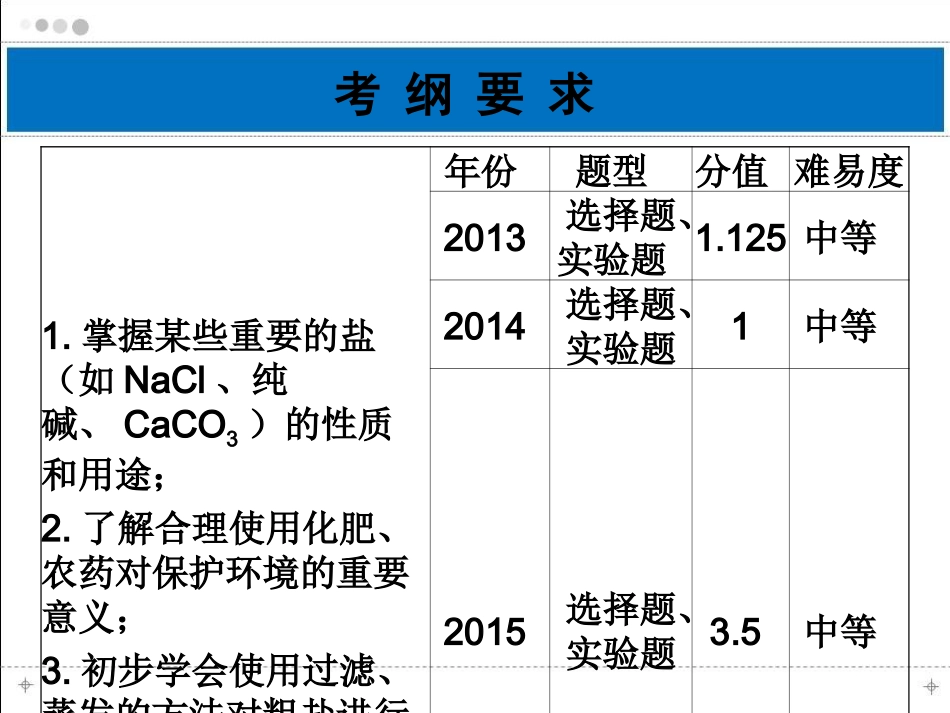
第21讲常见的盐与化肥考纲要求1.掌握某些重要的盐(如NaCl、纯碱、CaCO3)的性质和用途;2.了解合理使用化肥、农药对保护环境的重要意义;3.初步学会使用过滤、蒸发的方法对粗盐进行提纯。年份题型分值难易度2013选择题、实验题1.125中等2014选择题、实验题1中等2015选择题、实验题3.5中等考点1生活中常见的盐的性质和用途盐的定义:由阳离子(或NH4+)和阴离子形成的化合物。2、几种常见的盐金属酸根物质俗称及主要成分物理性质用途氯化钠食盐的主要成分白色粉末,水溶液有咸味,溶解度受温度影响不大①作调味品,腌制咸菜;②作防腐剂;③消除积雪;④农业上用氯化钠溶液来选种;⑤制生理盐水(浓度为0.9%的氯化钠溶液)。考点1生活中常见的盐的性质和用途物质俗称及主要成分物理性质用途碳酸钠纯碱、苏打白色粉末状固体,易溶于水用于玻璃、造纸、纺织、洗涤、食品工业等。碳酸钙石灰水、大理石的主要成分白色固体,不溶于水建筑材料;补钙剂;实验室制取二氧化碳的原料的主要成分。碳酸氢钠小苏打白色晶体,易溶于水制糕点所用的发酵粉;医疗上,治疗胃酸过多,反应化学方程式:NaHCO3+HCl=NaCl+H2O+CO2↑考点1生活中常见的盐的性质和用途例题1下列有关纯碱的说法正确的是:()A.纯碱难溶于水B.纯碱是碱而不是盐C.纯碱既可以从内盐湖提取,又可用“侯氏联合制碱法”生产D.纯碱可以做制糕点所用的发酵粉C易错提醒:1、食盐(NaCl)只是盐的一种,而盐是一类组成里含有金属(或铵根)阳离子和酸根阴离子的化合物。2、碳酸钠、碳酸氢钠属于盐类,但它们的水溶液呈碱性,能使无色酚酞溶液变红。3、游泳池一般用硫酸铜消毒;硫酸铜溶液和氢氧化钙溶液混合可制成农药波尔多液。考点1生活中常见的盐的性质和用途及时反馈1:1.(2014·大连)下列有关盐的用途中,叙述错误的是()A.碳酸氢钠用于烘制糕点B.碳酸钠用于造纸、纺织C.碳酸钙用于配制波尔多液D.氯化钠用于配制生理盐水2.(2015·杭州)Na2CO3的水溶液呈碱性,下列说法错误的是()A.碳酸钠在水中会电离出OH-B.往碳酸钠溶液中加稀硫酸后溶液的pH降低C.碳酸钠溶液中存在OH-D.往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色CA考点1生活中常见的盐的性质和用途3.(2015·济南)下列各组物质的鉴别中,所选的鉴别试剂,不正确的是()待鉴别的物质鉴别试剂A氧气、二氧化碳、空气燃着的木条B氯化铵固体和氯化钠固体氢氧化钠溶液C氢氧化钠溶液和碳酸钠溶液酚酞试液D稀盐酸和稀硫酸氯化钡溶液C考点2盐的化学性质(1)盐+金属→新金属+新盐(条件:盐可溶;活动性:金属>新金属)铁和硫酸铜反应方程式:。铜和硝酸银反应方程式:。(2)盐+酸→新盐+新酸(条件:产生气体或沉淀)碳酸钠和硫酸反应方程式:。碳酸氢钠和盐酸反应方程式:。硝酸银和盐酸反应方程式:。Fe+CuSO4=FeSO4+CuCu+2AgNO3=Cu(NO3)2+2AgNa2CO3+H2SO4=Na2SO4+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑AgNO3+HCl=HNO3+AgCl↓考点2盐的化学性质(3)盐+碱→新盐+新碱(条件:反应物需都可溶,且生成气体或沉淀)氢氧化钡和硫酸钠反应方程式:。氢氧化钠和氯化铁反应方程式:。氢氧化钾和氯化铵反应方程式:。(4)盐+盐→新盐1+新盐2(条件:反应物需都可溶,且生成沉淀盐)碳酸钠和氯化钙反应方程式:。硝酸钡和硫酸钠反应方程式:。Ba(OH)2+Na2SO4=BaSO4↓+2NaOH3NaOH+FeCl3=Fe(OH)3↓+3NaClKOH+NH4Cl=KCl+H2O+NH3↑Na2CO3+CaCl2=CaCO3↓+2NaClBa(NO3)2+Na2SO4=BaSO4↓+2NaNO3考点2盐的化学性质例题2X可以发生如下反应:1.X+酸=盐+HCl;2.X+盐=新盐+Ba(N03)2。X可能是()A.硫酸铜B.氯化钡C.氢氧化钠D.碳酸钠B易错提醒:1、硫酸钡、氯化银不溶于水,也不溶于酸。2、当碱与盐、盐与盐反应时,除了生成物中有沉淀、气体或水以外,参加反应的碱和盐、盐和盐都必须可溶。考点2盐的化学性质及时反馈2:4.(2014·广州)组成相似的盐具有一些相似的化学性质。(1)①Cu(NO3)2溶液和CuSO4溶液都含有大量(填离子符号)。②向Cu(NO3)2溶液中加入NaOH溶液,充分振荡。反应的化学方程式为。③向CuSO4溶液中加入过量的锌片,充分反应后,可看到的现象是,右图表示该反...