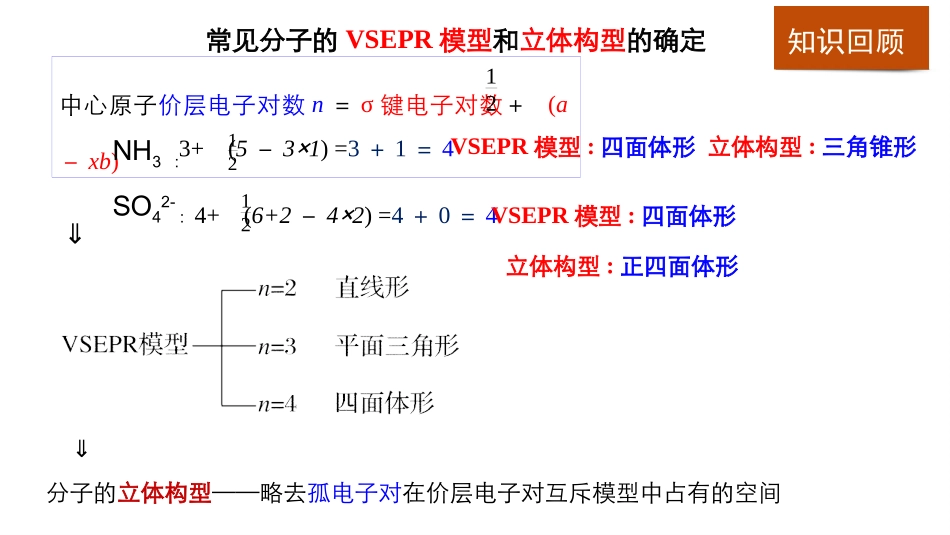
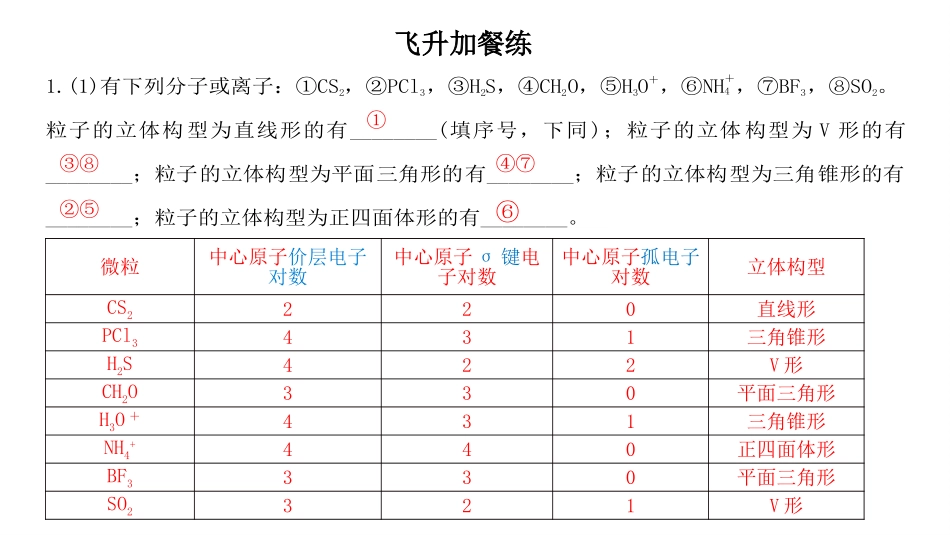
常见分子的VSEPR模型和立体构型的确定中心原子价层电子对数n=σ键电子对数+(a-xb)12知识回顾NH3:4+(6+2-4×2)=4+0=4SO42-:3+(5-3×1)=3+1=41212VSEPR模型:四面体形VSEPR模型:四面体形立体构型:正四面体形立体构型:三角锥形⇓⇓分子的立体构型——略去孤电子对在价层电子对互斥模型中占有的空间1.(1)有下列分子或离子:①CS2,②PCl3,③H2S,④CH2O,⑤H3O+,⑥NH+4,⑦BF3,⑧SO2。粒子的立体构型为直线形的有________(填序号,下同);粒子的立体构型为V形的有________;粒子的立体构型为平面三角形的有________;粒子的立体构型为三角锥形的有________;粒子的立体构型为正四面体形的有________。微粒中心原子价层电子对数中心原子σ键电子对数中心原子孤电子对数立体构型CS2220直线形PCl3431三角锥形H2S422V形CH2O330平面三角形H3O+431三角锥形NH4+440正四面体形BF3330平面三角形SO2321V形飞升加餐练①③⑧④⑦②⑤⑥(2)若ABn的中心原子上有一对孤电子对未能成键,当n=2时,其立体构型为________;当n=3时,其立体构型为________。12(a-xb)=1σ=2V形三角锥形σ=3C==O键与C—Cl键之间电子对的排斥作用强于C—Cl键与C—Cl键之间电子对的排斥作用(3)俗称光气的氯代甲酰氯分子(COCl2)为平面三角形,但C—Cl键与C==O键之间的夹角为124.3°;C—Cl键与C—Cl键之间的夹角为111.4°,解释其原因:分子中价层电子对之间的斥力主要顺序为:ⅰ.孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;ⅱ.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;ⅲ.X原子得电子能力越弱,A—X形成的共用电子对之间的斥力越强(4)氮可以形成多种离子,如N3-、NH-2、N-3、NH+4、N2H+5、N2H2+6等,已知N2H+5与N2H2+6是由中性分子结合质子形成的,类似于NH+4,因此有类似于NH+4的性质。①写出与N-3互为等电子体的物质的化学式:________(两种)。②预测下列微粒的立体构型:NH-2:________,N-3:________。③N-3的结构式为____________。CO2、N2OV形直线形[N===N===N]-原子总是相同,价电子总数相同2.(1)利用VSEPR模型推断分子或离子的立体构型。PO43-_正四面体形_;CS2_直线型_;AlBr3(共价分子)_平面三角形(2)按要求写出第二周期非金属元素构成的中性分子的化学式。平面三角形分子___BF3___,三角锥形分子___NF3__,四面体形分子__CF4__。(3)为了解释和预测分子的立体构型,科学家在归纳了许多已知的分子立体构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是_中心原子上的价电子都用于形成共价键__;另一类是_中心原子上有孤电子对_。BF3和NF3都是四个原子的分子,BF3的中心原子是___B_____,NF3的中心原子是_N__;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是:BF3分子中B原子的3个价电子都与F原子形成共价键,而NF3分子中N原子的3个价电子与F原子形成共价键,还有一对未成键的孤电子对,占据了N原子周围的空间,参与相互排斥,形成三角锥形3.试回答下列问题:(1)利用价层电子对互斥理论推断下列分子或离子的立体构型:SeO3__平面三角形__;SCl2__V形__;NO2+__直线形__;NO2-__V形__;HCHO__平面三角形__;HCN__直线型__。(2)利用价电子对互斥理论推断键角的大小:①甲醛中H—C—H的键角___<__120°(填“>”“<”或“=”,下同);②SnBr2分子中Br—Sn—Br的键角____<____120°;③PCl3分子中,Cl—P—Cl的键角___<___109.5°。(1)价层电子对数的计算(2))甲醛为平面形分子,由于C=O与C—H之间的排斥作用大于2个C—H之间的排斥作用,所以甲醛分子中C—H键与C—H键的夹角小于120°。SnBr2分子中,Sn原子的价电子对数是3,成键电子对数=2,孤电子对数=1,由于孤电子对与Sn-Br键的排斥作用大于SnBr键之间的排斥作用,故键角<120°。PCl3分子中,P的价层电子对数为4,成键电子对数=3,孤电子对数=1,由于孤电子对与P—Cl键的排斥作用大于P—Cl键间的排斥作用,所以Cl—P—Cl的键角小于109.5°。课堂反思•针对自己的错题,小结没掌握的知识...