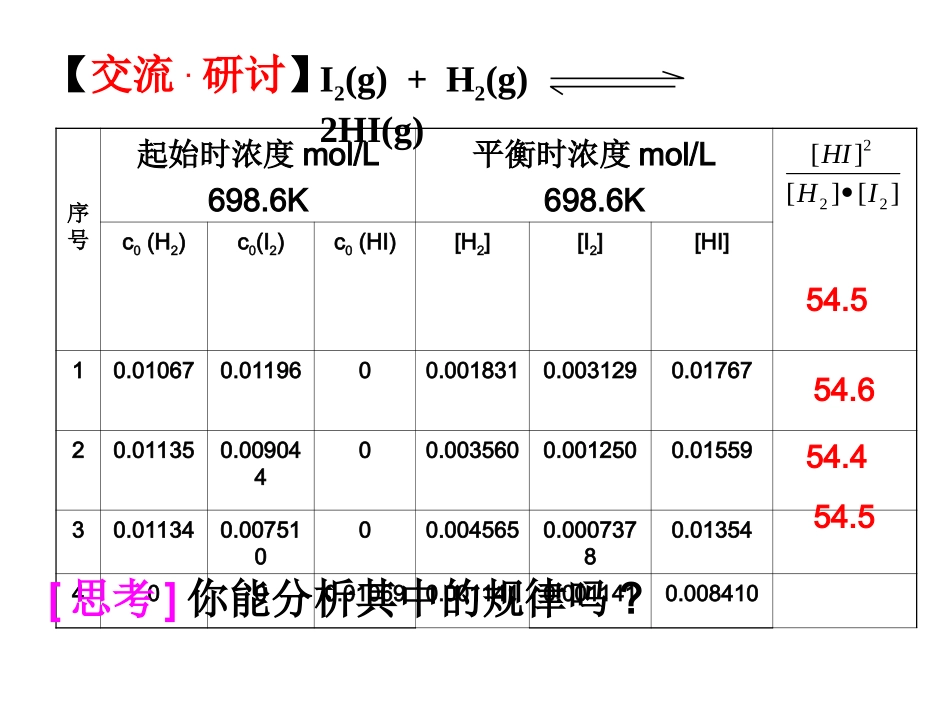
第1节化学平衡常数知识目标1、理解化学平衡常数的含义2、利用化学平衡常数进行计算3、了解化学平衡常数与浓度商的关系【交流.研讨】I2(g)+H2(g)2HI(g)序号起始时浓度mol/L698.6K平衡时浓度mol/L698.6Kc0(H2)c0(I2)c0(HI)[H2][I2][HI]10.010670.0119600.0018310.0031290.0176720.011350.00904400.0035600.0012500.0155930.011340.00751000.0045650.00073780.013544000.010690.0011410.0011410.00841054.554.654.454.5][][][222IHHI[思考]你能分析其中的规律吗?规律小结通过分析实验数据得出:(1)温度相同时,达到化学平衡状态为一常数;(2)这个常数与反应的起始浓度大小无关;(3)这个常数与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。][][][222IHHIK=单位:(mol•L-1)c+d-a-b含义:一定温度时,可逆反应达到平衡状态时,生成物平衡浓度系数次方之积与反应物平衡浓度系数次方之积的比值是一个常数,这个常数称为化学平衡常数化学平衡常数表达式书写平衡常数关系式的注意事项如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。CaCO3(s)CaO(s)+CO2(g)K=[CO2]CO2(g)+H2(g)CO(g)+H2O(l)K=[CO]/([CO2][H2])1/2N2(g)+3/2H2(g)NH3(g)2321223HNNHk1=NH3(g)1/2N2(g)+3/2H2(g)k2=k1-1N2(g)+3H2(g)2NH3(g)k3=k121.写出下列反应的平衡常数表达式,并观察平衡常数的有关规律•1同一个可逆反应,平衡常数的表达式不是唯一的,它与化学方程式的书写方式有关。•2对于同一个反应,正反应和逆反应的平衡常数互为倒数。•3平衡常数的单位与化学方程式表示形式相对应。平衡常数K的意义平衡常数的大小反映了化学反应可能进行的程度(即反应的限度),平衡常数的数值越大,说明反应进行得越完全。一般来说,如果一个反应的平衡常数大于105,通常认为反应可进行得比较完全,相反,如果一个反应的平衡常数小于在10-5,则认为这个反应很难进行。平衡常数K的应用aA+bBcC+dDBcAcDcCccbadQ=浓度商当Q=K时,反应为平衡状态当Q<K时,反应正向进行直至平衡当Q>K时,反应逆向进行直至平衡badcBADCK=课堂练习例1、(2006上海,25)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______,K值大小与温度的关系是温度升高,K值________。(填“一定增大”“一定减小”或“可能增大也可能减小”)。(后略)化学反应进行的程度越大可能增大也可能减小例2、(2007上海,25)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)=CH3OH(g)反应达到平衡时,平衡常数表达式K=_____,升高温度,K值___(填“增大”“减小”或“不变”)。300℃500℃otBtA时间(min)nAnB甲醇的物质的量(mol)223HCOOHCH减小例4.(2008山东,14)高温下,某反应达到平衡,平衡常数恒容时,温度升高,H2浓度减小。下列说法正确的是A.该反应是焓变为正值B.恒温恒容下,增大压强,H2浓度一定减小C.升高温度,逆反应速率减小D.该反应化学方程式为CO+H2OCO2+H2)()()()(222HcCOcOHcCOc催化剂高温A