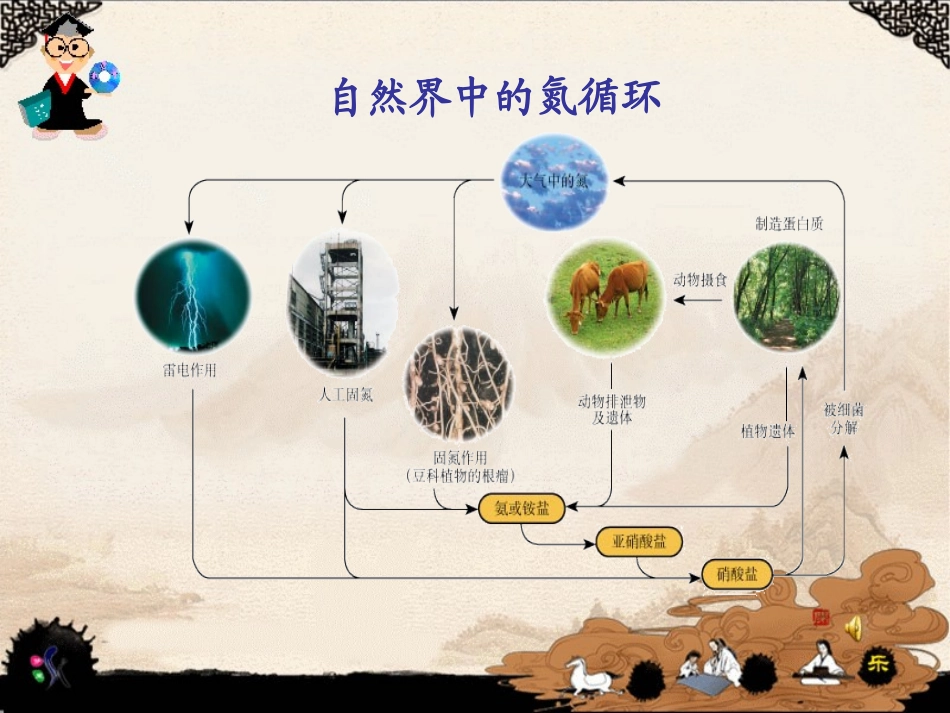
含氮化合物在生活中的意义:①氮是植物生长必不可少的元素之一。②农作物每年从土壤中吸收大量含氮化合物。导入新课导入新课含氮化合物的作用:①制造染料②制造人造纤维③制造油漆④制造炸药自然界中的氮循环氮的固定:将游离态的氮转化为化合态氮的方法土壤中含氮化合物的主要来源:1.雷雨放电;2.生物固氮;3.动物的排泄物或腐败尸体中含氮化合物进入土壤。在大气中,氮的含量为78%,却不能被人类呼吸利用,如何有效地利用廉价的自然资源生产含氮的化合物?1.合成氨的反应原理2.合成氨的基本生产过程3.合成氨的工业生产第二节:人工固氮技术——合成氨1.了解合成氨的反应原理2.了解合成氨的基本生产过程3.了解合成工业发展中需要解决的问题教学目标教学目标知识与能力情感与态度过程与方法利用多媒体动画、电脑图片等学习有研究合成氨的一般步骤和方法。充分发挥学生学习的主动性。培养学生勤于观察、勤于总结思考的科学态度。提高学生的科学素养。①合成氨的反应原理②合成氨生产的适宜条件合成氨生产的适宜条件教学重难点教学重难点重点难点N2(g)+3H2(g)2NH3(g)高温、高压催化剂通常以铁为主的催化剂。在400~500℃和10~30MPa的条件下最适宜。注意11.合成氨反应中催化剂的主要作用是什么?铁做催化剂可以显著提高反应速率。2.合成氨方案的主要优点是什么?反应物中氮气和氢气都可以从大气中获得。想一想3.合成氨反应是一个可逆、放热、气体分子总数减少的反应,根据勒夏特列原理分析工业适宜的反映条件。根据勒夏特列原理,温度越低,压强越大,该反应的平衡体系中氨的含量越高;但降低温度则反应速率降低,因此,适宜的条件才能适应工业生产。4.从原料、能源、设备等方面分析和推测合成氨反应在实际生产中可能遇到的问题?㈠从经济上考虑:产品的市场前景如何,物料的使用和转运、能耗、设备的投入和产出是否合理;㈡从环境影响考虑:厂址的选定、原料的处理、生产过程及“三废”的处理㈢还要考虑设备和技术条件能否合理,操作是否安全可靠,能否实现自动控制等。设备:三步骤:•造气制备合成氨的原料气•净化原料气的净化处理•合成使原料气进行反应合成氨制备合成氨的原料气①氮气的来源:取自空气,一是将空气液化后蒸发分离出氧气而获得氮气;另一是将空气中的氧气与碳作用生成二氧化碳,再除去二氧化碳得氮气.②氢气的来源:碳与水的作用或碳氢化合物与水的作用.C+H2O=CO+H2石油天然气焦炉气炼厂气含有大量碳氢化合物石油CH4+H2O=3H2+COCH4+2H2O=4H2+CO原料气净化处理:在制取原料其的过程中,常混有一些杂质,其中某些杂质会使合成氨的催化剂“中毒”,必须出去的过程。①用稀氨水吸收H2S杂质:NH3·H2O+H2S=NH4HS+H2O②原料气中将CO转化为CO2的方法:CO+H2O=CO2+H2③将CO2吸收的方法:K2CO3+CO2+H2O=2KHCO3④用醋酸、铜和氨配制成的溶液吸收CO、CO2、O2、H2S等少量有害气体。氨的合成与分离净化气体压缩机氨合成塔冷凝器分离器高温高压循环三步骤:•造气制备合成氨的原料气•净化原料气净化处理•合成使原料气进行化学反应合成氨为什么要循环操作?1.可以充分利用原料,降低成本。2.有利于实现全封闭、连续化生产、有利于减少工序、控制废弃物的排放。想一想说明合成氨工业可以进行的联合生产有或深加工有那些?合成氨与硝铵、碳铵等氮肥生产的联合;石油精炼厂与合成洗涤剂厂的联合生产。1.原料及原料气的净化原料中氮气在空气中是取之不尽用之不竭的;早期:以焦炭和水为原料生产水煤气制得氢。现在:用不同的固态、液态和气态的可燃物为原料制得氢。2.催化剂的改进催化剂的性质往往决定化学反应的条件,催化剂的突破可以彻底改变工艺流程。3.环境保护•废渣主要来自造气阶段。例:以煤为原料的产生的煤渣,以中有为原料产生的炭黑等,大都用于建材和肥料的原料。•废气主要是H2S和CO2等有害气体H2S用直接接触法或循环法回收CO2不是有害气体,但过多会导致温室效应,可作为尿素、碳铵等原料。•废液主要是含氰化物和氨的污水可以用生化、加压水解、氧化分解、化学沉淀、反吹回炉等方法处理含氰化物。可用蒸馏法回收含氨废水。①工业合成氨的原理是什么?氢气和氮气在...