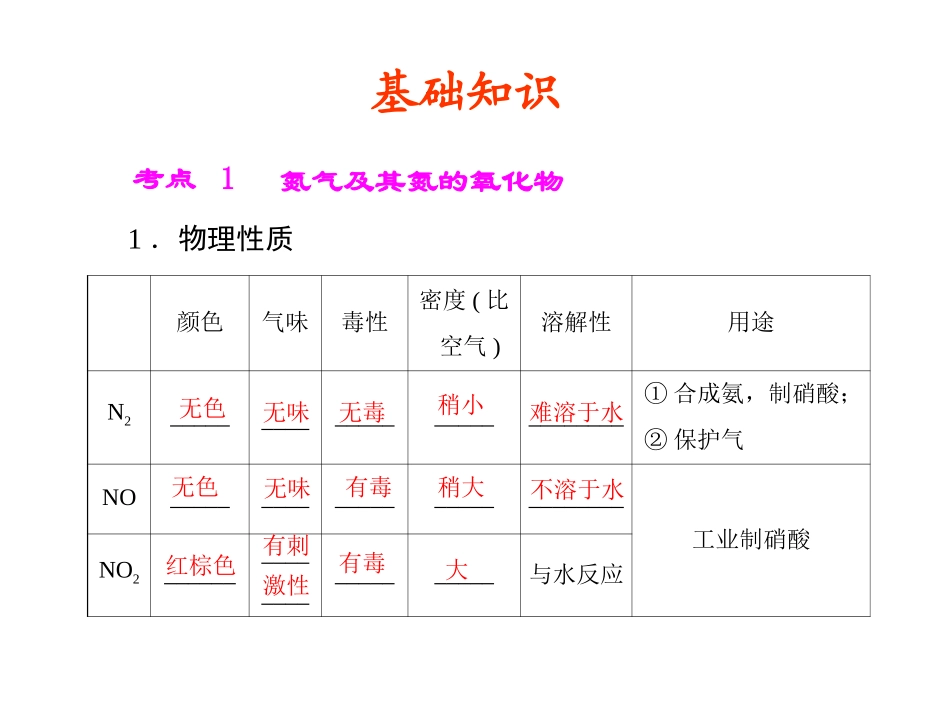
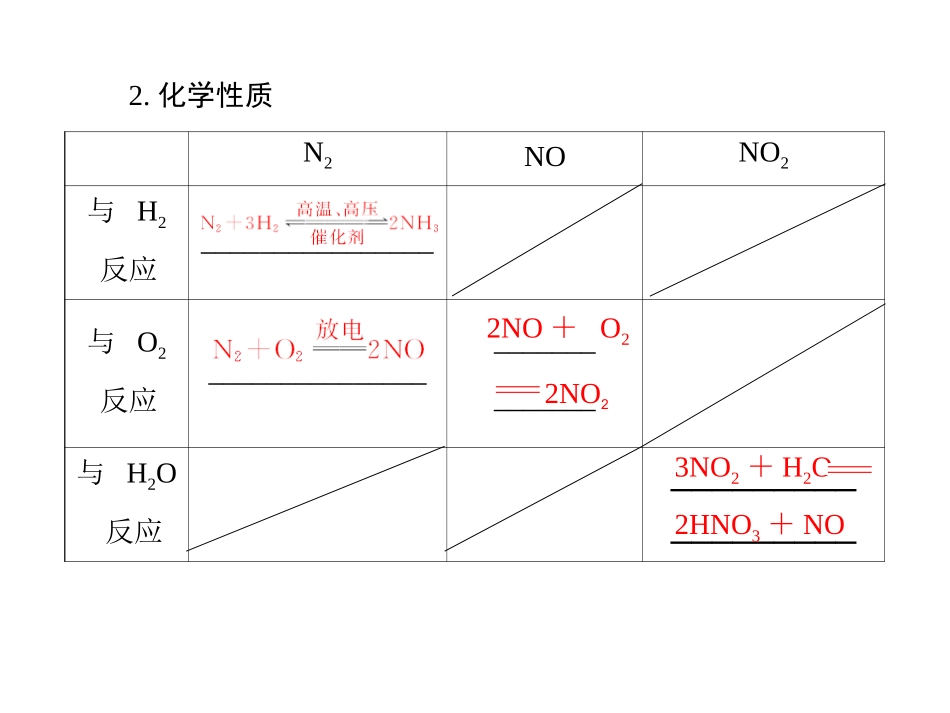
第三节氮及其化合物第三章非金属及其化合物南阳中学:梁家列24年12月27日颜色气味毒性密度(比空气)溶解性用途N2___________________________①合成氨,制硝酸;②保护气NO___________________________工业制硝酸NO2________________________与水反应考点1氮气及其氮的氧化物1.物理性质无色无味无毒大稍小无色红棕色无味有刺激性有毒难溶于水不溶于水有毒稍大基础知识N2NONO2与H2反应________________与O2反应_____________________________与H2O反应__________________2.化学性质2NO+O22NO23NO2+H2O2HNO3+NO1.N2化学性质稳定,下列事实不能支持这种说法的是()A.N2可填充入灯泡中作保护气B.液态氮用作冷冻剂C.放电条件下N2与O2化合生成NOD.工业合成氨需在高温、高压、催化剂条件下进行解析:N2与H2、O2对反应条件要求很高,表明N2稳定,化学性质不活泼;液态氮用作冷冻剂,是利用液态氮的汽化时吸热,与化学性质无关。B练习1:2.无色的混合气体甲中可能含NO、CO2、NO2、NH3、N2中的几种。将100mL气体甲经过图3-19-1实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为()图3-19-1BA.NH3、NO2、N2C.NH3、NO2、CO2B.NH3、NO、CO2D.NO、CO2、N2解析:N2在整个过程中不可能参加反应,A、D不正确;由于气体呈无色,C不正确;选项B符合题目要求。无刺激性液化极易氨气与铵盐考点21.氨气续表续表物理性质都是白色晶体,都易溶于水化学性质受热分解①NH4Cl化学方程式:________________________②NH4HCO3化学方程式:________________________________与碱的反应+-与稀烧碱溶液反应:NH4+OHNH3·H2O+-与浓烧碱溶液反应并加热:NH4+OHNH3↑+H2ONH4ClNH3↑+HCl↑NH4HCO3NH3↑+H2O+CO2↑2.铵盐1.证明氨气极易溶于水的实验为喷泉实验,下列甲、乙引发喷泉实验的操作及原理是什么?答:图甲装置操作:打开止水夹,将胶头滴管的液体挤出。原理:是因为上部烧瓶内气体压强突然减小而产生压强差形成喷泉;图乙装置操作:打开止水夹,用手(或热毛巾等)将烧瓶捂热,原理:氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。图3-19-2问题1:答:不能,二者都是加热变为气体,遇冷变固体(I2:物理变化;NH4Cl:化学变化)。将混合物溶于水,采用有机溶剂萃取的方法分离。2.NH4Cl与I2两种固体混合能否用加热法分离?若不能,用何种方法?3.如何检验NH+4?答:取少量的待检液于试管中,加入适量浓NaOH溶液并加热,将湿润的红色石蕊试纸放于试管口,观察试纸颜色变化,若变蓝,证明有NH+4,否则无NH+4。3.“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是()①实验室收集氨气采用图1所示装置②实验室中做氯气与钠的反应实验时采用图2所示装置③实验室中用玻璃棒分④实验室别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验中采用图3所示装置进行铜与稀硝酸的反应图3-19-3A.②③④B.①②③C.①②④D.①③④C“绿色化学”的思想是尽量使用无毒、无害的原料,采取合理安全的工艺合成产物,原子利用率为100%,无污染,对环境友好。练习2:4.(双选)氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是()A.NH4H是离子化合物B.NH4H溶于水,所形成的溶液显酸性C.NH4H与水反应时,NH4H是氧化剂D.NH4H固体投入少量的水中,有两种气体生成解析:NH4H与氯化铵的结构相似,应为离子化合物,A正确;NH4H与水反应有H2和NH3·H2O生成,故所形成的溶液显碱性,B错误;NH4H与水反应时,NH4H中-1价H失电子,是还原剂,C错误;NH4H固体投入少量的水中,有H2和NH3生成,D正确。BC考点3硝酸4HNO3或光照2H2O+4NO2↑+O2↑钝化3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2OCu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2OC+4HNO3(浓)CO2↑+4NO2↑+2H2O3FeO+10H++NO-3===3Fe3++NO↑+5H2O玻璃棕细续表5.下列有关硝酸的性质或实验表述中错误的是(①与FeO反应时,硝酸既显氧化性,又显示酸性)②欲迅速除去铝壶中的水垢又不损坏铝壶,可加入稀硝酸③把浓的硝酸滴加到表面皿的蓝色石蕊试纸上,试纸最后呈白色④为...