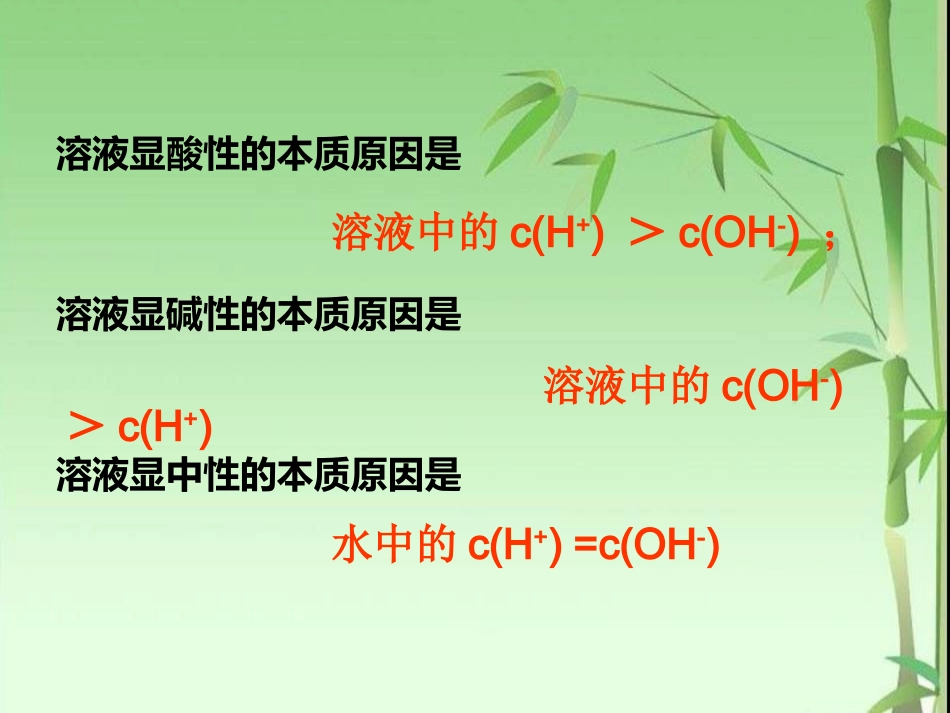
第三章水溶液中的离子平衡第三节盐的水解(第一课时)西安市第九十一中学汶雅溶液显酸性的本质原因是溶液显碱性的本质原因是溶液显中性的本质原因是水中的c(H+)=c(OH-)溶液中的c(H+)>c(OH-);溶液中的c(OH-)>c(H+)盐溶液NaClNa2SO4NaHCO3CH3COONaNa2CO3NH4Cl(NH4)2SO4酸碱性pH值分别测以下7种盐溶液的pH值,确定它们的酸碱性。取待测液滴于试纸中央,待变色后,与标准比色卡对比。中性酸性碱性中性碱性碱性酸性=7>7<7=7>7>7<7探究一:盐溶液的酸碱性盐溶液呈现不同酸碱性的原因H2OH++OH–纯水中:当分别加入CH3COONa、Na2CO3、NaCl、NH4Cl、形成溶液后,为什么会表现出不同的酸碱性呢?分析后,填写书P55表格三、盐类的水解11、定义:、定义:在盐溶液中,在盐溶液中,盐电离出的离子盐电离出的离子跟水所跟水所电离出的电离出的HH++或或OHOH--结合生成结合生成弱电解质弱电解质的反应就叫的反应就叫做盐类的水解。做盐类的水解。11、定义:、定义:在盐溶液中,在盐溶液中,盐电离出的离子盐电离出的离子跟水所跟水所电离出的电离出的HH++或或OHOH--结合生成结合生成弱电解质弱电解质的反应就叫的反应就叫做盐类的水解。做盐类的水解。2、水解的条件:盐易溶,有弱离子。3、水解的实质:生成弱电解质;促进水的电离。使c(H+)≠c(OH–)4、水解的特点:⑴可逆反应写“”⑵吸热⑶一般很微弱⑷水解平衡(动态)一般不用“↑”或“↓”;盐溶液NaClNa2SO4NaHCO3CH3COONaNa2CO3NH4Cl(NH4)2SO4酸碱性pH值盐的类型中性酸性碱性中性碱性碱性酸性=7>7<7=7>7>7<7强酸强碱盐强碱弱酸盐强碱弱酸盐强酸弱碱盐强酸强碱盐强碱弱酸盐强酸弱碱盐探究三:盐溶液的酸碱性的规律盐的另一种分类标准有弱才水解无弱不水解谁弱谁水解谁强显谁性同强显中性22..下列溶液能使酚酞指示剂显红色的是()下列溶液能使酚酞指示剂显红色的是()A.KA.K22COCO33B.NaB.NaNONO33C.NaC.Na22SOSO44D.FeClD.FeCl33A11..下列离子在水溶液中不会发生水解的是()下列离子在水溶液中不会发生水解的是()A.NHA.NH44++B.SOB.SO4422__C.AlC.Al33++D.FD.F__B课堂练习一3.下列盐的水溶液中,哪些呈酸性()哪些呈碱性()①FeCl3NaClO(NH②③4)2SO4④AgNO3Na⑤2SK⑥2SO4①③④②⑤比较比较NaNa22COCO33和和CHCH33COONaCOONa的碱性?的碱性?碳酸比醋酸的酸性弱,碳酸比醋酸的酸性弱,COCO332-2-越容越容易结合水电里出来的易结合水电里出来的HH++,,水解程度:水解程度:COCO332-2->>CHCH33COOCOO2-2-思考:越弱越水解越弱越水解等浓度的下列物质的溶液中:①BaCl2Na②2CO3NH③4ClCH④3COONa,其PH值由大到小的顺序是。课堂练习二②>④>>③练一练:判断下列溶液的酸碱性,并写出有关的离子方程式1.Na2SO4:2.NH4Cl:4.NaHCO3:中性NHNH44+++H+H22ONHONH33..HH22O+HO+H++酸性酸性HCO3-+H2OH2CO3+OH-碱性1.水解的定义2.水解的实质:破坏并促进水的电离3.水解的条件:盐需溶于水,并且有“弱”离子4.水解反应的特点:可逆、动态、吸热、5.水解规律:有弱才水解;无弱不水解;谁弱谁水解;谁强显谁性;同强显中性小结:盐类的水解思考1、NaHCO3、Na2CO3同样为强碱弱酸盐溶液,但浓度相同的这两种盐溶液却表现出不同的碱性,这是为什么?布置作业让我想想?2、CH3COONa溶液中有哪些离子?其浓度大小顺序是怎样的呢?