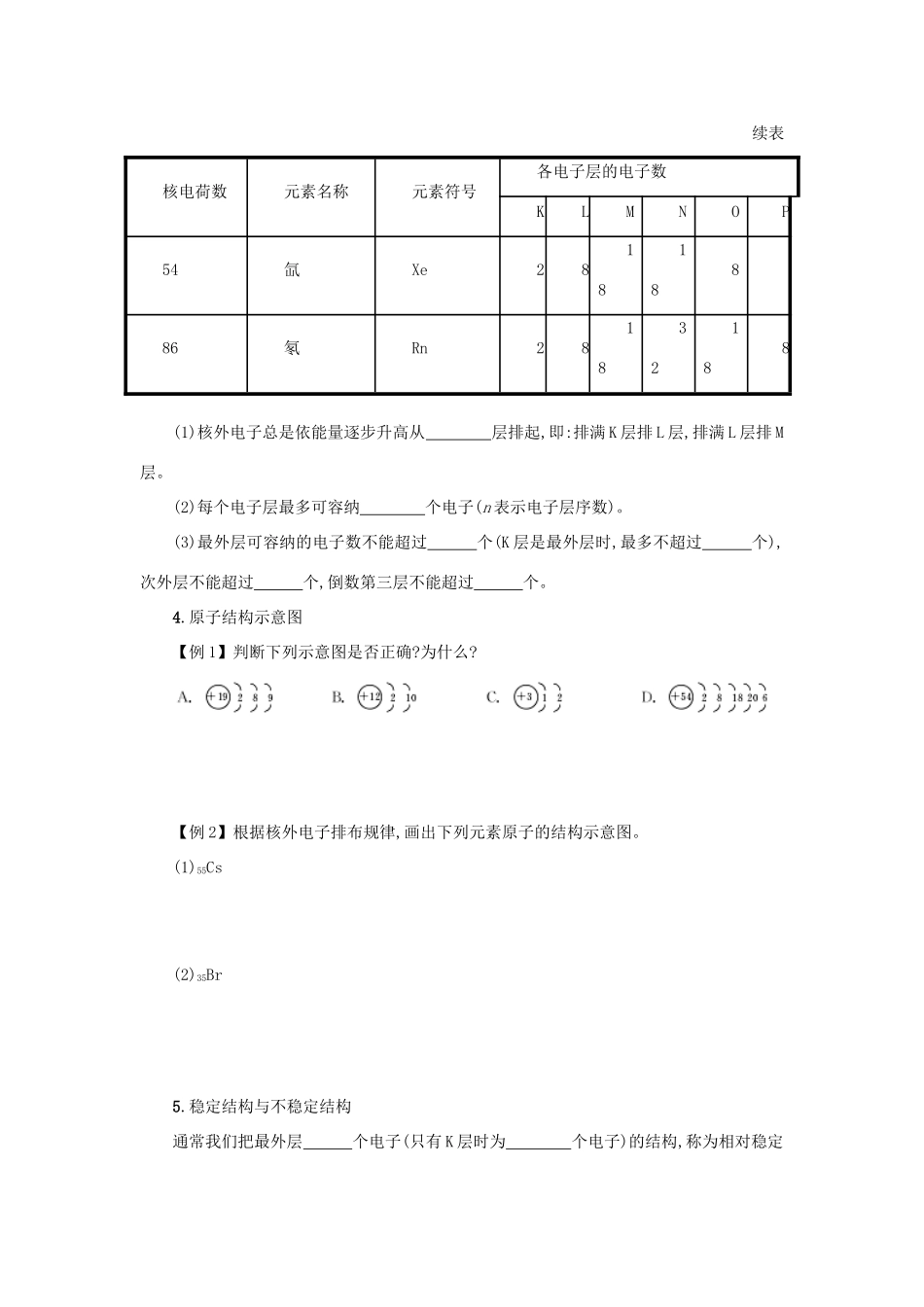
第1课时原子核外电子的排布及元素周期律学习目标1.了解原子核外电子排布。2.掌握元素核外电子、化合价、原子半径周期性变化规律。学习过程一、核外电子排布1.核外电子运动特征根据所给的一些数据请你总结电子运动的特征。(1)核外电子的质量:9.10×10-31kg。(2)炮弹的速度2km/s,人造卫星7.8km/s,宇宙飞船11km/s,氢核外电子2.2×108m/s。(3)乒乓球半径:4×10-2m;原子半径:约10-10m。2.核外电子分层排布阅读课本P13~14完成下表电子层序号1234567电子层符号电子能量电子离核由到,电子能量由到3.核外电子排布的规律阅读课本P13~14表12,及下表数据,归纳总结核外电子排布的规律。核电荷数元素名称元素符号各电子层的电子数KLMNOP2氦He210氖Ne2818氩Ar28836氪Kr28188续表核电荷数元素名称元素符号各电子层的电子数KLMNOP54氙Xe281818886氡Rn281832188(1)核外电子总是依能量逐步升高从层排起,即:排满K层排L层,排满L层排M层。(2)每个电子层最多可容纳个电子(n表示电子层序数)。(3)最外层可容纳的电子数不能超过个(K层是最外层时,最多不超过个),次外层不能超过个,倒数第三层不能超过个。4.原子结构示意图【例1】判断下列示意图是否正确?为什么?【例2】根据核外电子排布规律,画出下列元素原子的结构示意图。(1)55Cs(2)35Br5.稳定结构与不稳定结构通常我们把最外层个电子(只有K层时为个电子)的结构,称为相对稳定结构。化学反应中,具有不稳定结构的原子,总是“想方设法”通过各种方式使自己的结构趋向于稳定。二、元素周期律1.电子层排列的周期性根据1~18号元素核外电子排布,总结核外电子排布的规律。2.化合价的周期性变化根据1~18号元素的化合价,总结化合价的变化规律:。(1)1~18号元素中,除了O、F外,最高正价=;最低负价与最高正价的关系为;(2)金属元素无价(除0价外,在化学反应中只显价);既有价又有价的元素一定是非金属元素;(3)氟元素无价,氧元素无最高价。3.原子半径的递变规律根据下表数据,总结原子半径变化规律:。元素HHe原子半径0.037nm—元素LiBeBCNOFNe原子半径0.152nm0.089nm0.082nm0.077nm0.075nm0.074nm0.071nm—元素NaMgAlSiPSClAr原子半0.1860.1600.1430.1170.1100.1020.099—径nmnmnmnmnmnmnm(1)同主族元素原子半径随原子序数增大而逐渐增大的原因。(2)同周期元素原子半径随原子序数增大而逐渐减小的原因。(3)试比较Na+和F-半径大小。随堂检测1.某元素的原子核外有3个电子层,最外层有4个电子,该原子核内的质子数为()A.14B.15C.16D.172.原子核外的M电子层和L电子层最多容纳的电子数的关系是()A.M>LB.M