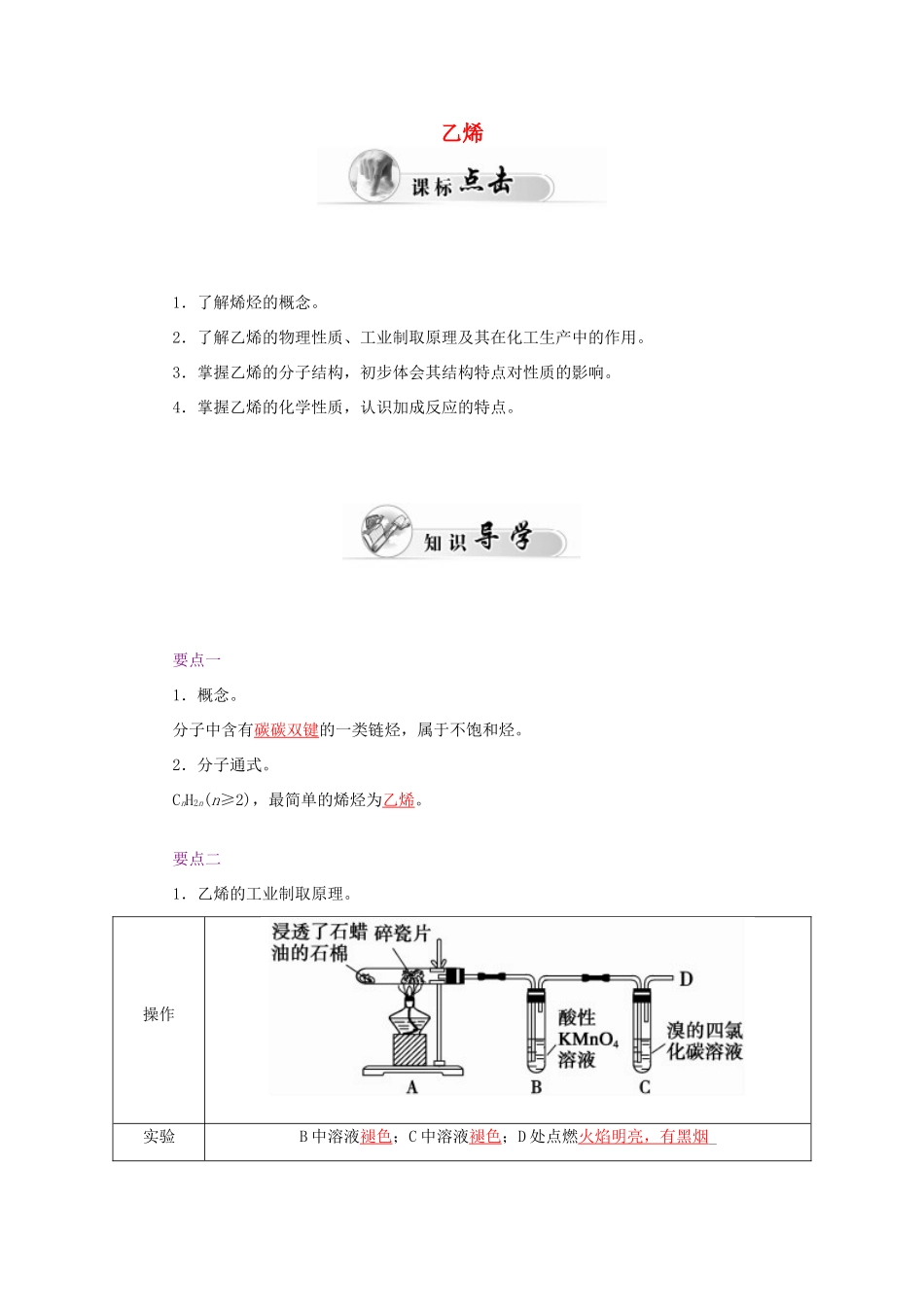
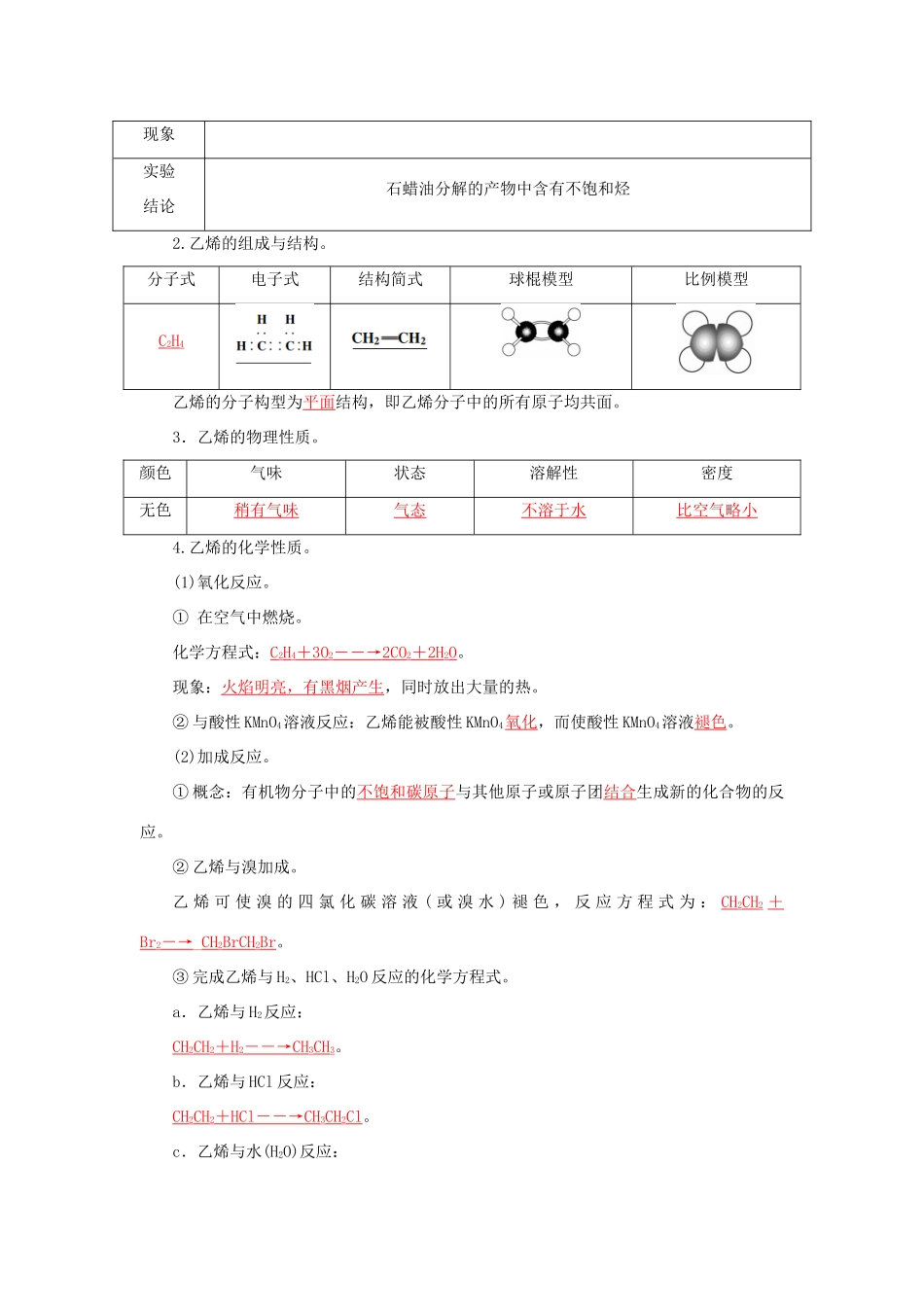
乙烯1.了解烯烃的概念。2.了解乙烯的物理性质、工业制取原理及其在化工生产中的作用。3.掌握乙烯的分子结构,初步体会其结构特点对性质的影响。4.掌握乙烯的化学性质,认识加成反应的特点。要点一1.概念。分子中含有碳碳双键的一类链烃,属于不饱和烃。2.分子通式。CnH2n(n≥2),最简单的烯烃为乙烯。要点二1.乙烯的工业制取原理。操作实验B中溶液褪色;C中溶液褪色;D处点燃火焰明亮,有黑烟_现象实验结论石蜡油分解的产物中含有不饱和烃2.乙烯的组成与结构。分子式电子式结构简式球棍模型比例模型C2H4乙烯的分子构型为平面结构,即乙烯分子中的所有原子均共面。3.乙烯的物理性质。颜色气味状态溶解性密度无色稍有气味气态不溶于水比空气略小4.乙烯的化学性质。(1)氧化反应。①在空气中燃烧。化学方程式:C2H4+3O2――→2CO2+2H2O。现象:火焰明亮,有黑烟产生,同时放出大量的热。②与酸性KMnO4溶液反应:乙烯能被酸性KMnO4氧化,而使酸性KMnO4溶液褪色。(2)加成反应。①概念:有机物分子中的不饱和碳原子与其他原子或原子团结合生成新的化合物的反应。②乙烯与溴加成。乙烯可使溴的四氯化碳溶液(或溴水)褪色,反应方程式为:CH2CH2+Br2―→_CH2BrCH2Br。③完成乙烯与H2、HCl、H2O反应的化学方程式。a.乙烯与H2反应:CH2CH2+H2――→CH3CH3。b.乙烯与HCl反应:CH2CH2+HCl――→CH3CH2Cl。c.乙烯与水(H2O)反应:CH2CH2+H2O――→CH3CH2OH。④加成反应与取代反应的区别。加成反应是有机物分子中双键或三键两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应,其特点是:“断一加二,都进来”。“断一”是指双键或三键中的一个不稳定键断裂;“加二”是指加两个其他原子或原子团,每一个不饱和碳原子上各加上一个。取代反应是分子中某些原子或原子团被其他原子或原子团所代替的反应。其特点是“上一下一,有进有出”。(3)加聚反应:乙烯能自身发生加成反应生成高分子化合物聚乙烯,其反应方程式为nCH2CH2――→CH2—CH2。5.乙烯的用途。(1)乙烯是重要的化工原料,用来制聚乙烯塑料、聚乙烯纤维、乙醇等。乙烯的产量可以用来衡量一个国家的石油化工发展水平。(2)在农业生产中用作催熟剂。【应用思考】1.乙烯燃烧时为什么火焰明亮并伴有黑烟?提示:乙烯燃烧时火焰明亮并伴有黑烟的原因是乙烯的含碳量高。乙烯燃烧不充分时,一部分碳呈游离态,所以冒黑烟,又因该部分碳被烧成炙热状态,所以乙烯的火焰很明亮。2.检验甲烷和乙烯气体可以采用什么方法?除去甲烷气体中的乙烯可以采用什么方法?提示:检验甲烷和乙烯可以选择溴水或酸性KMnO4溶液,出现褪色现象的为乙烯;但是除去甲烷中的乙烯只能用溴水,因为酸性KMnO4溶液可以将乙烯氧化成CO2气体而引入新的杂质。1.关于乙烯的分子结构,描述错误的是(D)A.乙烯的结构简式为:CH2CH2B.乙烯是最简单的烯烃C.乙烯分子中所有的原子都在同一平面上D.乙烯分子中所有的原子都在一条直线上2.既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的乙烯的方法是(A)A.通入足量溴水中B.在空气中燃烧C.通入酸性高锰酸钾溶液中D.在一定条件下通入氢气3.下列不可能是乙烯加成反应产物的是(B)A.CH3CH3B.CH3CHCl2C.CH3CH2OHD.CH3CH2Br解析:A、C、D三项分别是乙烯与H2、H2O、HBr的加成反应产物;B项中2个Cl在同一个C上,不可能是乙烯的加成反应产物。4.通常用来衡量一个国家的石油化学工业发展水平的标志是(B)A.石油的产量B.乙烯的产量C.合成纤维的产量D.硫酸的产量1.从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是(C)A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟而腐烂D.利用高锰酸钾溶液的氧化性,催熟水果解析:长途运输水果时往往会释放乙烯气体,乙烯是水果催熟剂,容易造成水果早熟甚至腐烂、霉变,将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,利用高锰酸钾溶液的氧化性吸收水果产生的乙烯,可防止水果早...