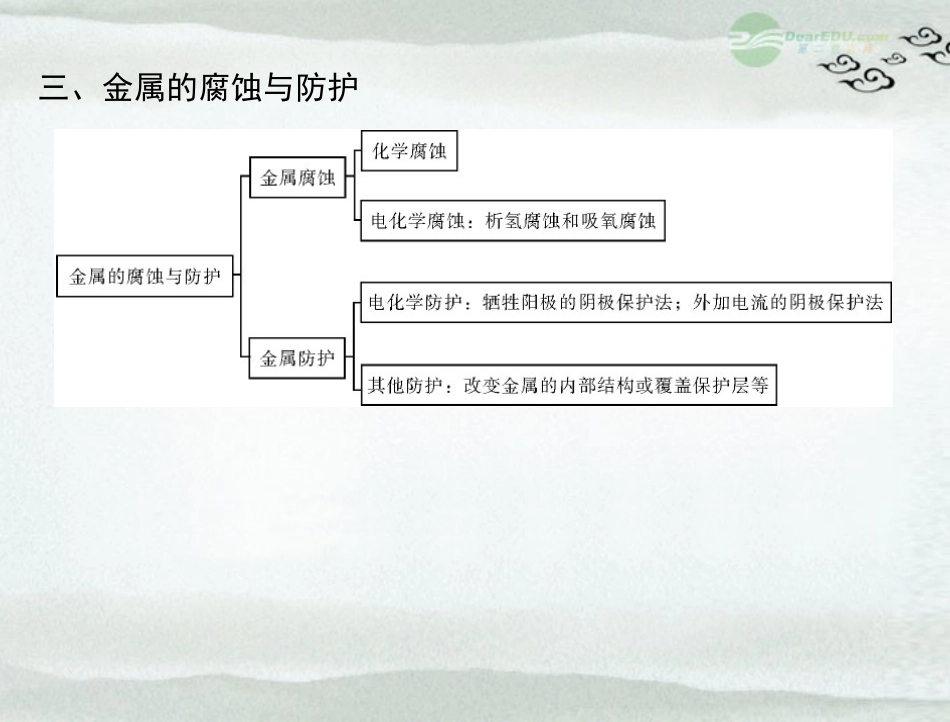
一、原电池及化学电源二、电解原理及应用三、金属的腐蚀与防护考点1原电池原理及电极反应式的书写【考题1】(2011年安徽高考)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是()。A.正极反应式:Ag+Cl--e-===AgClB.每生成1molNa2Mn5O10转移2mol电子C.Na+不断向“水”电池的负极移动D.AgCl是还原产物解析:由电池总反应可知银失去电子被氧化,即银作负极,产物AgCl是氧化产物,A、D都不正确;在原电池中阳离子向正极移动,C错误;每生成1molNa2Mn5O10就有2molAg被氧化,转移电子2mol,因此选项B正确。答案:B【考题2】(2010年全国高考)下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为TiO2/STiO2/S*(激发态)TiO2/S*―→TiO2/S++e-I-3+2e-―→3I-2TiO2/S++3I-―→2TiO2/S+I-3下列关于该电池叙述错误的是()。A.电池工作时,I-离子在镀铂导电玻璃电极上放电B.电池工作时,是将太阳能转化为电能C.电池的电解质溶液中I-和I3的浓度不会减少D.电池中镀铂导电玻璃为正极答案:A解析:由题干所给电池中的反应可知,二氧化钛电极上的材料失去电子作负极,则镀铂导电玻璃为正极,电解质中的I-3到铂电极上得电子转化为I-,然后I-到二氧化钛电极上将部分电子失去,再次转化为I-3,故整个过程中I-3、I-浓度不会减少,综合题目中的四个方程式可知,该电池的能量转化过程为有机光敏染料吸收光能变为激发态,激发态在电池内部转化为电能后又恢复到基态,如此循环。【考题3】(2010年广东高考,双选)铜锌原电池(如下图)工作时,下列叙述正确的是()。A.正极反应为:Zn-2e-===Zn2+B.电池反应为:Zn+Cu2+===Zn2++CuC.在外电路中,电子从负极流向正极D.盐桥中的K+移向ZnSO4溶液答案:BC解析:题给电池中Zn为负极:Zn-2e-===Zn2+,Cu为正极:Cu2++2e-===Cu,A项错误;电池总反应为:Zn+Cu2+===Zn2++Cu,B项正确;原电池工作时,外电路中电子由负极流出经导线流向正极,C项正确;负极上由于Zn放电,ZnSO4溶液中Zn2+的浓度增大,故盐桥中的Cl-移向ZnSO4溶液,D项错误。考点2电解原理及其应用【考题4】(2011年全国高考)用石墨作电极电解CuSO4溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液)。中加入适量的(A.CuSO4C.CuOB.H2OD.CuSO4·5H2O解析:用石墨作电极电解CuSO4溶液的电解方程式是2CuSO4+2H2O2H2SO4+2Cu+O2↑,欲使电解液复原,就要缺什么补什么,选项C正确。答案:C【考题5】(2011年上海高考)用电解法提取氯化铜废液中的铜,方案正确的是()。A.用铜片连接电源的正极,另一电极用铂片B.用碳棒连接电源的正极,另一电极用铜片C.用氢氧化钠溶液吸收阴极产物D.用带火星的木条检验阳极产物解析:用电解法提取氯化铜废液中的铜时,铜必须作阴极,阳极是铜或惰性电极,阴极的反应式为:Cu2++2e-===Cu。答案:B【考题6】(2011年海南高考)一种充电电池放电时的电极反应为当为电池充电时,与外电源正极连接的电极上发生的反应是()。A.H2O的还原B.NiO(OH)的还原C.H2的氧化D.Ni(OH)2的氧化H2+2OH--2e-===2H2O;NiO(OH)+H2O+e-===Ni(OH)2+OH-。解析:由题中给出的电极反应可判断出做原电池时,H2是还原剂被氧化、NiO(OH)是氧化剂被还原,则充电时H2是还原产物、NiO(OH)是氧化产物,与正极相连的是阳极发生氧化反应,所以“Ni(OH)2的氧化”正确。答案:D【考题7】(2010年海南高考,双选)利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是()。A.电解时以精铜作阳极B.电解时阴极发生还原反应C.粗铜连接电源负极,其电极反应是Cu-2e-===Cu2+D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥溶解,Cu2+得到电子后析出,附着在阴极上,故精铜作阴极;Fe2+、Zn2+进入溶液,然后是铜失去电子,变成Cu2+进入溶液,解析:电...