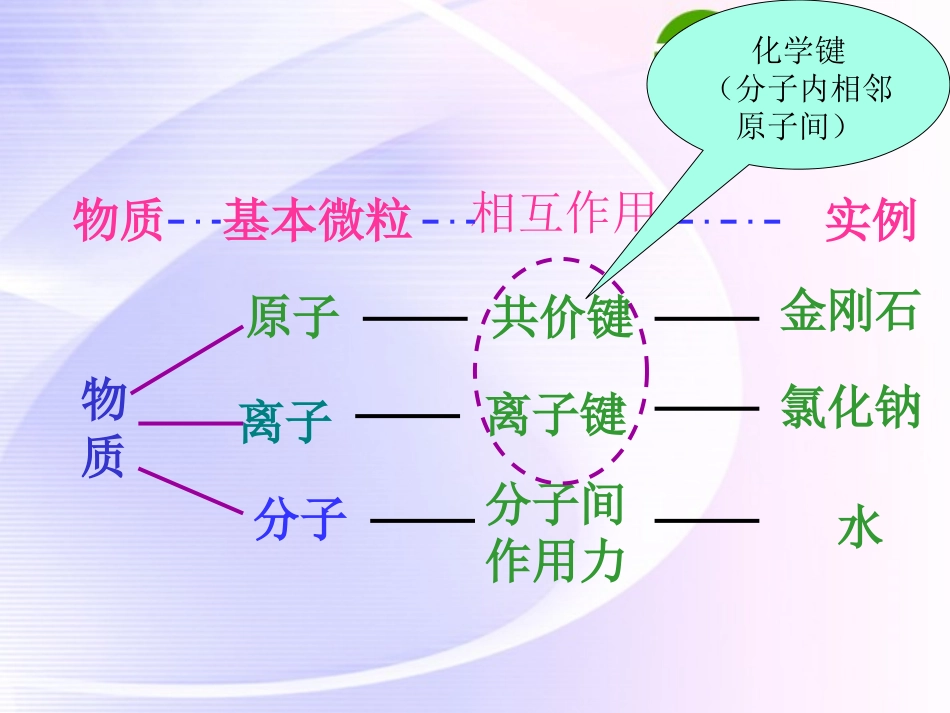
第二单元微粒之间的相互作用力(第一轮复习)LCL物质原子分子离子相互作用基本微粒物质实例共价键离子键分子间作用力金刚石氯化钠水化学键(分子内相邻原子间)比较离子键共价键概念阴、阳离子之间强烈的静电作用原子间通过共用电子对所形成的强烈的相互作用成键微粒阴、阳离子原子成键条件活泼金属元素与活泼非金属元素的原子相结合同种或不同种非金属元素的原子相结合作用微粒作用力大小意义化学键分子间作用力原子间分子之间作用力大作用力小影响化学性质和物理性质影响物理性质(熔沸点等)为什么HF、H2O和NH3的沸点会反常呢?一些氢化物的沸点思考1.是不是所有的金属和非金属元素之间都能形成离子键?为什么?2.是否只有金属与非金属之间才能形成离子键?为什么?3、判断下列物质中那些物质含有离子键?KCl、H2SO4、Na2O、H2O、KOH、CO2、NH4Cl、SO3、Mg(OH)2、(NH4)2CO3KCl、Na2O、KOH、NH4Cl、Mg(OH)2、(NH4)2CO3-----含金属或铵根的【2010.宁波模拟】下列物质性质中,可以证明某化合物内一定存在离子键的是()A、水溶液能导电B、由金属和非金属元素的原子组成C、熔融状态能导电D、可以溶于水【2010.绍兴模拟】下列物质变化时,需克服的作用力不属于化学键的是()A、HCl溶于水B、碘升华C、H2O电解D、烧碱熔化CB【2009.台州模拟】列说法中正确的是()A.含有离子键的化合物必是离子化合物B.具有共价键的化合物就是共价化合物C.共价化合物可能含离子键D.离子化合物中可能含有共价键【2010.衢州模拟】下列物质中含有共价键的离子化合物是()A.Ba(OH)2B.CaCl2C.H2OD.H2ADA5、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是()A.食盐和蔗糖熔化B.钠和硫熔化C.碘和干冰升华D.二氧化硅和氧化钠熔化微粒间作用力表示方法————电子式与结构式书写1、原子电子式:用小黑点表示最外层电子均匀分布在元素符号上下左右;一、电子式书写写出下列原子的电子式:MgNAlSCNaClH1、原子电子式:用最外层电子均匀分布在元素符号上下左右;一、电子式书写写出下列离子的电子式:Mg2+Na+OH-O22-Cl-2、离子电子式:(1)金属阳离子:直接用相对应的离子符号来表示;(2)阴离子(铵根离子):原子最外层H需2个电子,其他原子需8个电子饱和,再加上中括号,最后在右上角标出所电荷数。Al3+S2-NH4+C22-一、电子式书写3、共价分子电子式:把非金属原子的电子式合并,原子间相互共用电子达到饱和(H需2个电子,其他原子需8个电子)。写出下列化合物的电子式:H2OCO2N2C2H4NH3HClOH2O2Cl2CCl4—OH(羟基)、—CH3(甲基)一、电子式书写4、离子化合物电子式:阴阳离子的电子式的合并,多个离子的写在左右或上下。写出下列化合物的电子式:Na2SMgCl2NH4ClNa2O2CaC2NaOH离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并AB型AB2型A2B型1、原子电子式:用最外层电子均匀分布在元素符号上下左右;一、电子式书写2、离子电子式:(1)金属阳离子:直接用相对应的离子符号来表示;(2)阴离子(铵根离子):原子最外层H需2个电子,其他原子需8个电子饱和,再加上中括号,最后在右上角标出所电荷数和电性。3、共价分子电子式:把非金属原子的电子式合并,原子间相互共用电子达到饱和(H需2个电子,其他原子需8个电子)。4、离子化合物电子式:阴阳离子的电子式的合并,多个离子的写在左右或上下。1、下面所熟悉的物质:①O2、②金刚石、③NaBr、④H2SO4、⑤Na2CO3、⑥Na2S、⑦NaHSO4(1)这些物质中,只含共价键的是_______;只含离子键的是_______;既含共价键又含离子键的是_______。(2)将NaHSO4溶于水,破坏了NaHSO4中的______,写出其电离方程式__________________;在熔融状态下破坏其______;电离方程式_________________________;2、在下列变化中,①I2升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水。未发生化学键破坏的是_______;仅发生离子键破坏的是_______;仅发生共价键破坏的是_______;既发生离子键破坏,又发生共价键破坏的是_______。