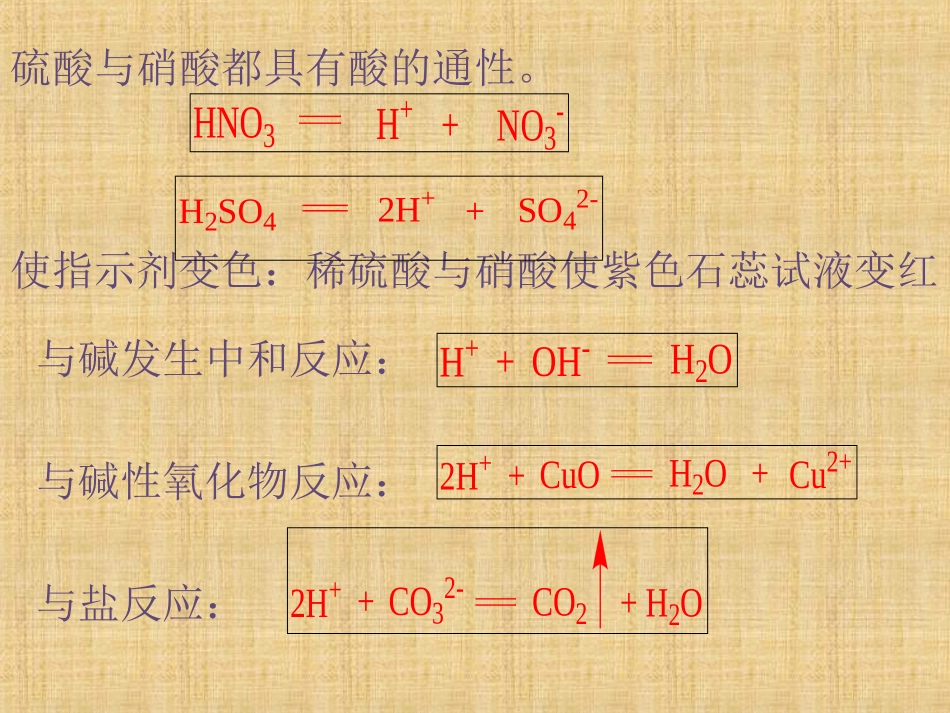
第二节硫酸和硝酸的氧化性思考与交流(1)硫酸、硝酸、盐酸都是酸,他们在组成上有什么特点?(2)这种特点与酸的通性有什么关系?用离子方程式表示。(3)实验室里用金属与酸反应制取氢气时,往往用稀硫酸或盐酸,而不用浓硫酸或硝酸,这是为什么?硫酸与硝酸都具有酸的通性。使指示剂变色:稀硫酸与硝酸使紫色石蕊试液变红与碱发生中和反应:与碱性氧化物反应:与盐反应:H2SO4+2H+SO42-HNO3+H+NO3-+H+OH-H2O+2H+H2OCuOCu2+++2H+H2OCO32-CO2+一、浓硫酸1.浓硫酸的物理性质色态:无色、粘稠的油状液体;沸点:约338℃,难挥发性酸(高沸点酸);密度:1.84g/cm3,高密度酸;溶解性:跟水任意比互溶,溶解放出大量热。【思考】浓硫酸应如何稀释?2.浓硫酸的强氧化性(1)脱水性a.浓硫酸与木屑、棉花、纸屑反应b.浓硫酸与蔗糖反应(2)吸水性【思考】浓硫酸的吸水性与脱水性有什么区别?答:吸水性是指浓硫酸直接与水分子结合。脱水性是指浓硫酸将许多有机物中的氢、氧元素按水分子的比例脱去。3.与铜反应若铜过量,硫酸能否完全反应?为什么?Cu+2H2SO4(浓)CuSO4SO22H2O△++在常温下,浓硫酸跟某些金属,如铁、铝等接触时。能够使金属表面生成一薄层致密的氧化物薄膜,从而阻止内部的金属继续跟硫酸发生反应(钝化现象)。因此,冷的浓硫酸可以用铁或铝的容器贮存。但受热时,浓硫酸可以与铁、铝发生反应。小常识探究:浓硫酸与炭反应是否生成了二氧化碳、水和二氧化硫?按正确的顺序连接下列仪器,并说明你的理由。4.与木炭反应2H2SO4(浓)2SO2CO22H2O+++C△稀硫酸浓硫酸由电离出的H+引起的,可氧化金属活动顺序表氢前的金属由硫酸分子中+6价硫元素引起的,可氧化金属活动顺序表氢后的金属具有弱氧化性具有强氧化性。能氧化大多数的金属(除Au、Pt)学会对比稀硫酸的氧化性和浓硫酸的氧化性有何不同?二、硝酸1.硝酸的物理性质(1)纯硝酸是无色、易挥发、有刺激性气味的液体;(2)能以任意比溶于水;(3)密度比水大;(4)沸点低:83℃;(5)常用浓硝酸的浓度为69%,98%的浓硝酸叫做“发烟硝酸”。(1)具有酸的通性与酸、碱指示剂作用与金属作用H+与金属氧化物作用与碱作用与某些盐作用2.硝酸的化学性质HNO3H+NO3-+(2)不稳定性保存:密封于棕色瓶中,并放在阴暗处【思考】久置浓硝酸为什么呈黄色?答:硝酸分解产生NO2,NO2溶于硝酸而使硝酸呈黄色。4HNO34NO2O22H2O光照或△++(3)与金属反应a.Cu跟浓硝酸的反应b.Cu跟稀硝酸的反应结论:硝酸具有强的氧化性4HNO32NO22H2O++CuCu(NO3)2(浓)+8HNO32NO4H2O++3CuCu(NO3)2(稀)+3大量实验证明:不论浓、稀硝酸都有很强的氧化性,几乎能与所有金属(除Pt、Au等少数金属外)反应,如:Mg、Al、Zn、Fe、Cu等。但Al、Fe在冷、浓硝酸中要发生钝化。可以用铁、铝制的容器盛装浓硫酸或浓硝酸Pt、Au不与硝酸反应,但能与王水(浓硝酸与浓盐酸以体积比1:3组成的混合物,具有极强的氧化性,能氧化Pt、Au等极不活泼的金属)反应看一看(4)与非金属反应硝酸具有强的氧化性,也能跟许多非金属(如碳)反应总结:硝酸浓度越大,氧化性越强。氧化性:浓HNO3>稀HNO3C4HNO3+CO24NO22H2O++(浓)△硝酸的工业用途氧化性酸小结:硝酸(稀或浓)、硫酸(浓)、次氯酸、王水(硝酸和盐酸)等,都是具有强氧化性的酸。易钝化物质小结:Mg、Al在空气中其表面形成致密的氧化物薄膜而钝化。Al、Fe在冷的浓硫酸、浓硝酸中其表面形成致密的氧化物薄膜而钝化。课堂小结