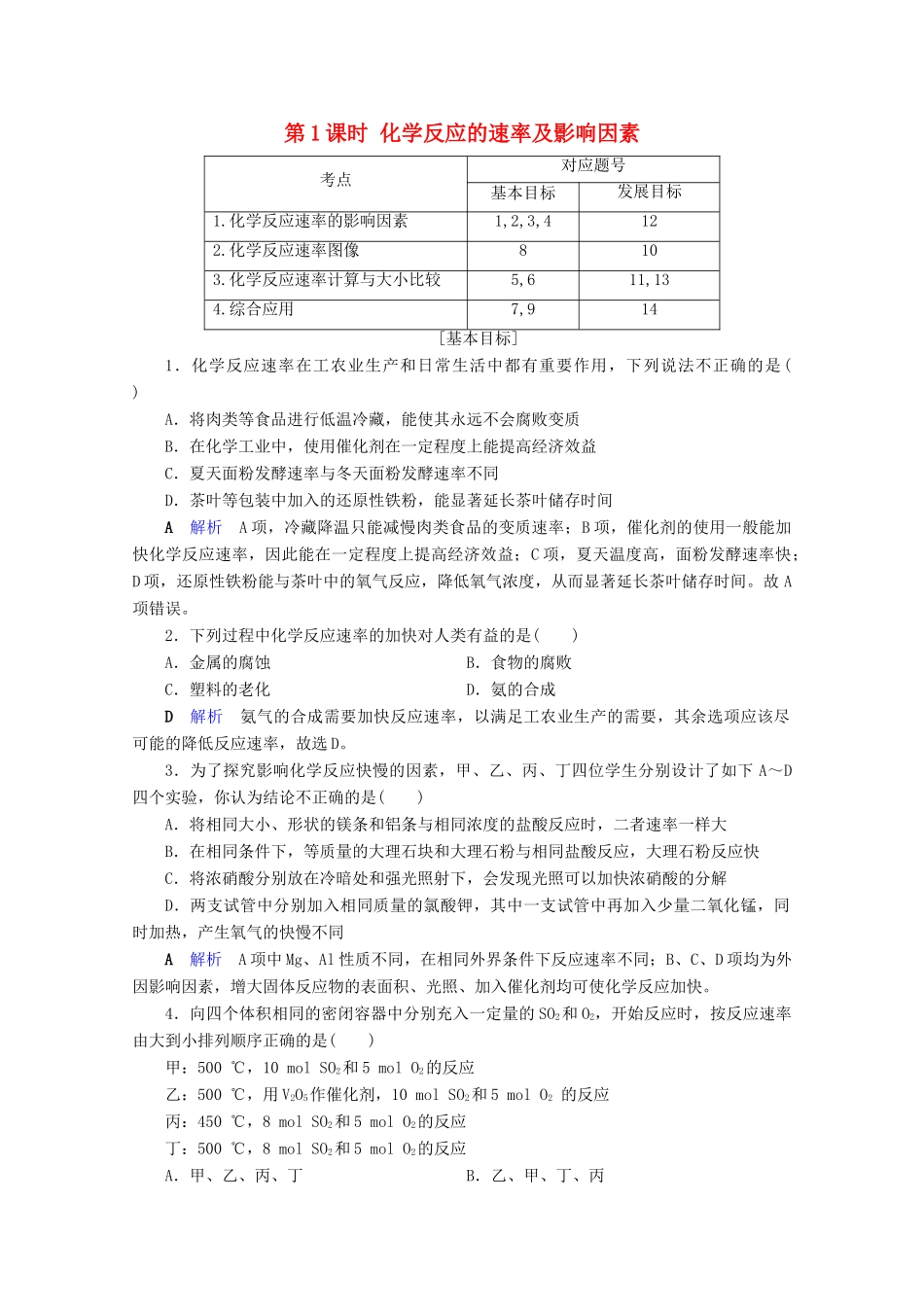
第1课时化学反应的速率及影响因素考点对应题号基本目标发展目标1.化学反应速率的影响因素1,2,3,4122.化学反应速率图像8103.化学反应速率计算与大小比较5,611,134.综合应用7,914[基本目标]1.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法不正确的是()A.将肉类等食品进行低温冷藏,能使其永远不会腐败变质B.在化学工业中,使用催化剂在一定程度上能提高经济效益C.夏天面粉发酵速率与冬天面粉发酵速率不同D.茶叶等包装中加入的还原性铁粉,能显著延长茶叶储存时间A解析A项,冷藏降温只能减慢肉类食品的变质速率;B项,催化剂的使用一般能加快化学反应速率,因此能在一定程度上提高经济效益;C项,夏天温度高,面粉发酵速率快;D项,还原性铁粉能与茶叶中的氧气反应,降低氧气浓度,从而显著延长茶叶储存时间。故A项错误。2.下列过程中化学反应速率的加快对人类有益的是()A.金属的腐蚀B.食物的腐败C.塑料的老化D.氨的合成D解析氨气的合成需要加快反应速率,以满足工农业生产的需要,其余选项应该尽可能的降低反应速率,故选D。3.为了探究影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是()A.将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,二者速率一样大B.在相同条件下,等质量的大理石块和大理石粉与相同盐酸反应,大理石粉反应快C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同A解析A项中Mg、Al性质不同,在相同外界条件下反应速率不同;B、C、D项均为外因影响因素,增大固体反应物的表面积、光照、加入催化剂均可使化学反应加快。4.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是()甲:500℃,10molSO2和5molO2的反应乙:500℃,用V2O5作催化剂,10molSO2和5molO2的反应丙:450℃,8molSO2和5molO2的反应丁:500℃,8molSO2和5molO2的反应A.甲、乙、丙、丁B.乙、甲、丁、丙C.乙、甲、丙、丁D.丁、丙、乙、甲、B解析本题比较的是三种因素(催化剂、温度和浓度)影响化学反应速率的情况,甲、乙相比,不同的是乙中使用了催化剂,所以反应速率乙>甲。甲、丁相比,丁中SO2的浓度小于甲中的浓度,所以反应速率甲>丁。丙、丁相比,丙中的温度较低,故反应速率关系为丁>丙。故反应速率由大到小的顺序为乙、甲、丁、丙。5.将N2、H2的混合气体分别充入甲、乙、丙三个容器后,测得反应速率分别为甲中v(H2)=3mol·(L·min)-1;乙中v(N2)=2mol·(L·min)-1;丙中v(NH3)=1mol·(L·min)-1。则三个容器中合成氨的速率()A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)D解析N2、H2合成氨的反应为N2(g)+3H2(g)2NH3(g),三个容器中均转化为N2的反应速率:甲v(N2)=v(H2)=1mol·(L·min)-1;乙v(N2)=2mol·(L·min)-1;丙v(N2)=v(NH3)=0.5mol·(L·min)-1;即v(乙)>v(甲)>v(丙)。6.一定温度下,在固定体积的密闭容器中发生下列反应:2HIH2+I2。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为()A.5sB.10sC.大于10sD.小于10sC解析随着反应不断进行:c(HI)逐渐减小,v正逐渐减小。所以,c(HI)由0.07mol·L-1降到0.05mol·L-1,所用时间应大于10s。7.某温度下,浓度都是1mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z。反应2min后,测得参加反应的X2为0.6mol·L-1,用Y2表示的反应速率v(Y2)=0.1mol·L-1·min-1,生成的c(Z)为0.4mol·L-1,则该反应的化学方程式是()A.X2+2Y2===2XY2B.2X2+Y2===2X2YC.3X2+Y2===2X3YD.X2+3Y2===2XY3答案C8.用6gCaCO3与100mL稀盐酸反应制取少量的CO2,反应过程中生成CO2的体积(已折算为标准状况)随反应时间变化的情况如图所示。下列说法正确的是()A.OE段表示的平均反应速率最快,可能的原因是该反应是放热...