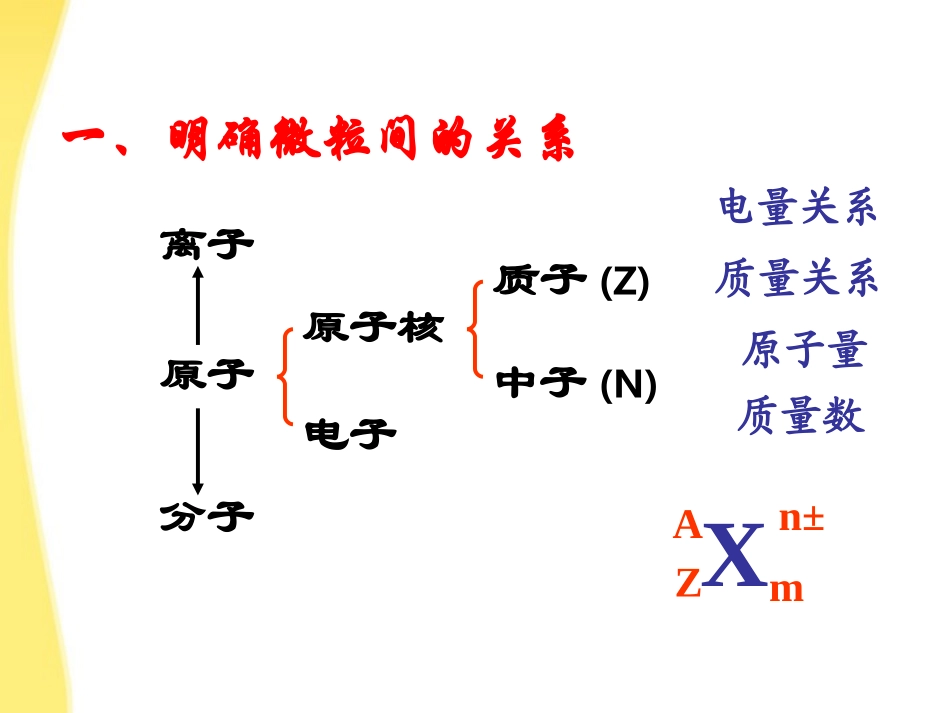
复习第一教时学习目的:1、掌握物质结构的有关概念2、掌握原子结构与元素性质的关系原子分子原子核电子质子(Z)中子(N)离子一、明确微粒间的关系电量关系质量关系质量数原子量XZAmn±例1(00)136C—NMR(核磁共振)可以用于含碳化合物的结构分析,136C表示的碳原子A.核外有13个电子,其中6个能参与成键B.核内有6个质子,核外有7个电子C.质量数为13,原子序数为6,核内有7个质子D.质量数为13,原子序数为6,核内有7个中子D巩固练习例2(97)X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系正确的是A.a-c=m-nB.a-b=n-mC.c-d=m+nD.b-d=n+mD二、核外电子排布的一般规律:1、K层为最外层时,最多容纳电子数------------。2、其他各层为最外层最多容纳电子数------------。3、次外层最多容纳电子数--------------------------。4、倒数第三层最多容纳电子数-------------------。5、第n层最多容纳电子数-------------------------。2个8个18个32个2n2个三、比较微粒的半径大小1、同周期元素的原子或离子2、同主族元素的原子或离子3、相同电子层结构的离子4、同一元素的原子与离子Na、Mg、AlCl-、S2-、P3-F-、Cl-、Br-、I-Li、Na、K、RbO2-、F-、Na+、Mg2+、Al3+Cl、Cl-、Mg2+、Mg、例3(99s)下列化合物中阳离子与阴离子半径比最小的是A.NaFB.MgI2C.BaI2D.KBrB巩固练习四、理清几个概念的区别与联系1、核数、同位素与同素异形体(1)、4019K和4020Ca(2)、3517Cl和3717Cl(3)、H2和D2(4)、O2和O3(5)、H2O和H2O22、原子的相对原子质量(原子量)和元素的相对原子质量3、原子的近似相对原子质量(质量数)和元素的近似相对原子质量3517Cl34.96975.77%3717Cl36.96624.23%氯元素的相对原子质量:氯元素的近似相对原子质量:6、用电子式表示离子化合物与共价化合物形成过程4、离子键与共价键(极性键与非极性键)5、离子化合物与共价化合物原子之间通过共用电子对形成的相互作用叫共价键。使阴、阳离子结合成化合物的静电作用叫离子键。含有离子键的化合物叫离子化合物只含共价键的化合物叫共价化合物例4、指出下列物质哪些含有极性键、哪些含有非极性键?CO2、N2、MgCl2、H2O、H2O2、Na2O2、HD、KOH、NH4Cl。例5、写出下列微粒的电子式Na2O2、CO2、Mg(OH)2HClO巩固练习例6、用电子式表示下列物质的形成过程H2S、Na2O7、共价键的极性强弱与稳定性强弱8、键的极性与分子的极性9、化学键与范德华力(物质的熔沸点)例5、下列叙述中错误的是A、离子化合物中不可能存在非极性键B、离子键只存在于离子化合物中,不存在于共价化合物中C、由极性键结合的分子不一定是极性分子D、极性分子一定不含非极性键E、离子化合物中不一定含有金属元素F、非金属元素间可能形成离子化合物AD巩固练习例6、在下列各对化合物中,化学键类型相同的是A、HCl和MgCl2B、H2O2和CO2C、CO2和CH4D、NaCl和NaOHC例8、下列过程中,共价键被破坏的是A、碘升华B、溴蒸气被木炭吸附C、蔗糖溶于水D、SO2气体溶于水D巩固练习例9、下列关系式中正确的是A、键的极性:C-N>C-OB、沸点:F2