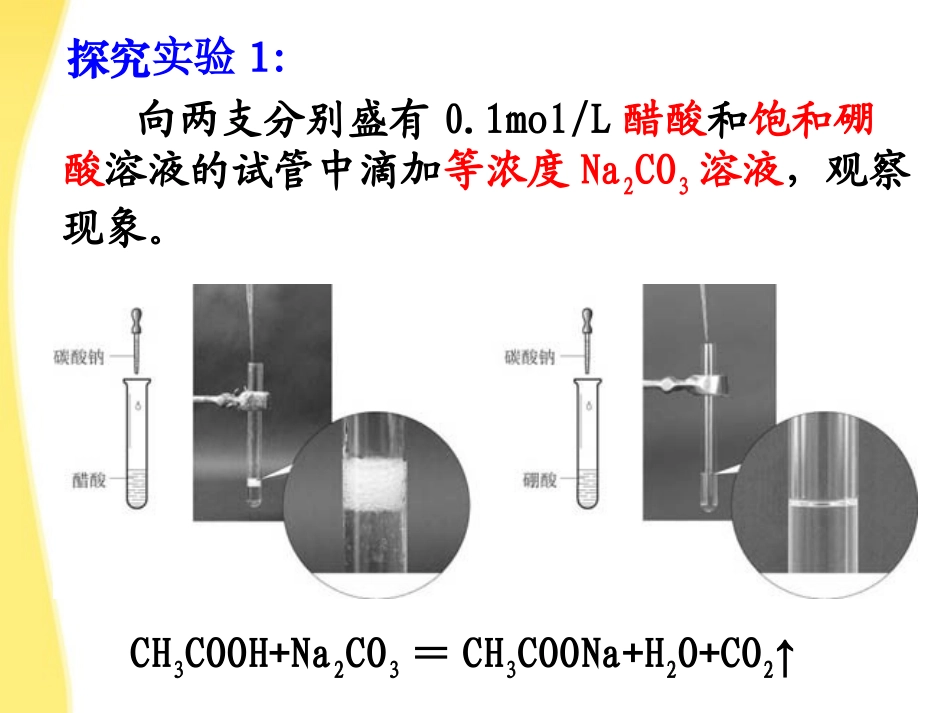
弱电解质的电离向两支分别盛有0.1mol/L醋酸和饱和硼酸溶液的试管中滴加等浓度Na2CO3溶液,观察现象。探究实验1:CH3COOH+Na2CO3=CH3COONa+H2O+CO2↑第一节弱电解质的电离第一节弱电解质的电离第三章水溶液中的离子平衡探究实验2:分别取约2mL浓度均为0.1mol/L的盐酸、醋酸溶液倒入两支试管中,然后分别测定这两种酸的pH。注:测定溶液pH的方法为取一小块试纸在表面皿上,用洁净的玻璃棒蘸取待测液点(或滴)于试纸的中部,观察变化稳定后的颜色,与标准比色卡对照,读出溶液的pH(读数为整数)。结论:HCl完全电离,电离程度为100%。醋酸部分电离,电离程度较小。探究实验2:分别测定0.1mol/L的盐酸、醋酸溶液的pH。试剂pH0.1mol/L盐酸0.1mol/L醋酸溶液130.10.001C(H+)/(mol/L)强电解质:在水溶液中能完全电离的电解质称强电解质.一、强弱电解质一、强弱电解质在水溶液中部分电离的电解质称弱电解质.弱电解质:弱酸:弱酸:CHCH33COOHCOOH、、HH22COCO33、、HClOHClO、、HFHF、、HH22SOSO33、、HH22SS等等弱碱:弱碱:NHNH33·H·H22OO、、Fe(OH)Fe(OH)33、、Cu(OH)Cu(OH)22等等极弱电解质:水(H2O)强酸:强酸:HClHCl、、HH22SOSO44、、HNOHNO33、、HClOHClO44、、HBrHBr等等强碱:强碱:NaOHNaOH、、KOHKOH、、Ca(OH)Ca(OH)22、、Ba(OH)Ba(OH)22等等大多数盐类:AgNO3、KNO3、NH4Cl、Na2CO3等等请写出H2SO4、H2CO3、NHNH33·H·H22OO、、Na2CO3的电离方程式。强电解质弱电解质电离方程式的书写:——完全电离,书写时用“=”号(2)弱电解质(1)强电解质——部分电离,书写时用“”号往实验2已取的0.1mol/L的盐酸中加入少量NaCl晶体、往实验2已取的0.1mol/L的醋酸溶液中加入少量CH3COONH4晶体,振荡溶解后分别测定所得溶液的pH。探究实验3:试剂pH盐酸中加入NaCl后醋酸溶液中加入CH3COONH4后C(H+)/(mol/L)探究实验3:1明显增大0.1明显减小探究实验2:试剂pH0.1mol/L盐酸0.1mol/L醋酸溶液130.10.001C(H+)/(mol/L)CHCH33COOCOO--+H+H++→→CHCH33COOHCOOH时间反应速率弱电解质分子电离成离子的速率离子结合成弱电解质分子的速率CHCH33COOHCOOH→→CHCH33COOCOO--+H+H++两种速率相等,处于电离平衡状态CHCH33COOHCOOHCHCH33COOCOO--+H+H++结论:醋酸在水溶液中的电离是一个可逆过程。将冰醋酸溶于水在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等且溶液中分子和离子的浓度保持不变时,电离过程就达到了平衡状态,叫做电离平衡。二、弱电解质的电离平衡1.概念3.电离常数(K)——电离平衡的平衡常数CHCH33COOHCHCOOHCH33COOCOO--+H+H++c(CH3COO-).c(H+)c(CH3COOH)K=K值越大,电离程度越大请写出请写出HClOHClO、、NHNH3·H·H22OO的电离常数表达的电离常数表达式式K的意义:弱酸电离常数(K)H3PO4CH3COOHH2CO3几种常见弱酸的电离常数(25℃)K值越大,相应弱酸(或弱碱)的酸(或碱)性越强。K1=7.1×10-3K2=6.3×10-8K3=4.2×10-13K=1.75×10-5K1=4.4×10-7K2=4.7×10-1125℃时不同浓度的醋酸溶液中溶液浓度(mol/L)K0.21.75×10-50.11.75×10-50.0011.75×10-5K值与浓度无关。CHCH33COOHCHCOOHCH33COOCOO--+H+H++不同温度下0.1mol/LCH3COOH的电离常数(不考虑醋酸的挥发)温度()℃K01.657×10-5101.729×10-5201.753×10-5251.754×10-5温度越高,K值越大结论:CHCH33COOHCHCOOHCH33COOCOO--+H+H++2.外界因素对电离平衡移动的影响(1)温度其他条件不变时,升高温度,平衡向着电离的方向移动加入的物质平衡移动方向c(CH3COOH)c(H+)c(CH3COO-)冰醋酸醋酸钠固体NaOH固体正逆增大减小增大增大增大减小增大增大正减小在CH3COOH溶液中分别加入少量下列物质,对CH3COOH的电离平衡各有什么影响?CHCH33COOHCHCOOHCH33COOCOO--+H+H++2.外界因素对电离平衡移动的影响(2)浓度通过物质的加入使平衡中某种物质的浓度发生改变,根据勒夏特列原理,平衡就向减弱这种改变的方向移动。【本节小结】电解质强电解质弱电解质概念电离平衡电离常数影响因素存在【知识应用】石蕊溶液为什么能够指示溶液的酸碱性?资料:酸碱指示剂是一些有机弱酸或弱碱,在...