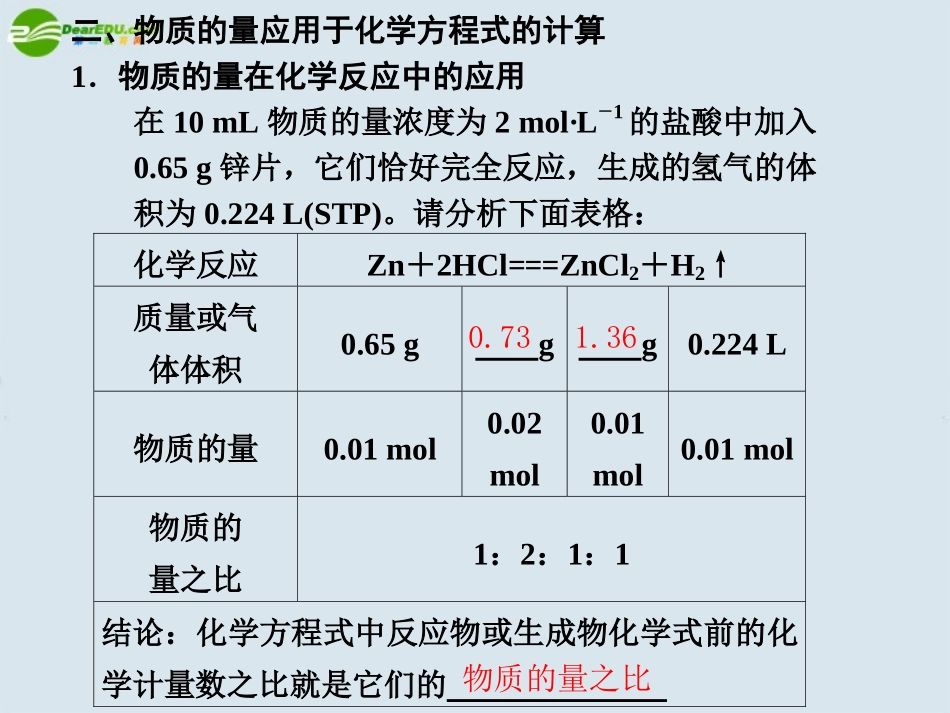
复习课基础梳理一、“物质的量”的“桥梁”作用物质的量、粒子数、物质的质量,标况下气体体积、物质的量浓度之间的关系【例1】下列叙述正确的是()A.48gO3气体含有6.02×1023个O3分子B.常温常压下,4.6gNO2气体含有1.81×1023个NO2分子C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+D.标准状况下,3.36LH2O含有9.03×1023个H2O分子解析A项中O3的分子数为48g48g/mol×6.02×1023/mol=6.02×1023,故A正确。B项中4.6gNO2含有的原子个数约为1.81×1023,而分子个数由于存在2NO2N2O4的转化,无法计算出其中NO2的具体分子数,B错。C项因不知其体积,只知道浓度,无法计算Cu2+的个数,C错。D项中标准状况下水不是气体,D错。A二、物质的量应用于化学方程式的计算1.物质的量在化学反应中的应用在10mL物质的量浓度为2mol·L-1的盐酸中加入0.65g锌片,它们恰好完全反应,生成的氢气的体积为0.224L(STP)。请分析下面表格:化学反应Zn+2HCl===ZnCl2+H2↑质量或气体体积0.65ggg0.224L物质的量0.01mol0.02mol0.01mol0.01mol物质的量之比1:2:1:1结论:化学方程式中反应物或生成物化学式前的化学计量数之比就是它们的0.731.36物质的量之比2.从物质的量的角度认识化学方程式的意义对于2H2+O2=====点燃2H2O,可理解为2molH2和O2在点燃的条件下恰好完全反应生成H2O。1mol2mol【例2】400mL某浓度的NaOH溶液恰好与5.6L的Cl2(标准状况)完全反应。计算(1)NaOH溶液的物质的量浓度(2)生成的NaClO的物质的量(假设反应前后溶液的体积不变)解析Cl2+2NaOH===NaClO+NaCl+H2O22.4L2mol1mol5.6Ln(NaOH)n(NaClO)22.4L5.6L=2moln(NaOH)=1moln(NaClO)∴n(NaOH)=5.6L×2mol22.4L=0.5moln(NaClO)=5.6L×1mol22.4L=0.25mol∴[NaOH]=n(NaOH)V=0.5mol0.4L=1.25mol·L-1答案(1)NaOH溶液的物质的量浓度为1.25mol·L-1。(2)生成NaClO的物质的量为0.25mol。随堂训练1.设阿伏加德罗常数为NA,则下列说法正确的是()A.常温常压下,11.2L甲烷中含有的氢原子数为2NAB.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NAC.常温下,2.7g铝与足量的盐酸反应,生成H2的物质的量为0.15molD.常温下,1L0.1mol·L-1MgCl2溶液中含Cl-数为0.1NA解析A项中在常温常压下11.2LCH4物质的量小于0.5mol,氢原子数小于2NA;B项中0.3molSO2含氧原子数为0.6NA;D项中1L0.1mol·L-1MgCl2溶液中Cl-数为0.2NA。答案C2.某化合物由NaCl、MgCl2、AlCl3三种物质组成,已知钠、镁、铝三种元素的质量比为23:16:9,则NaCl、MgCl2、AlCl3三种物质的物质的量之比为________,当Cl-为1mol时,混合物的质量是________g。解析混合物中钠、镁、铝三元素的物质的量比为:n(Na)∶n(Mg)∶n(Al)=(23/23g·mol-1)∶(16/24g·mol-1)∶(9/27g·mol-1)=3∶2∶1;按3molNaCl、2molMgCl2、1molAlCl3混合后的三种物质中含氯离子的物质的量:n(Cl-)=3mol×1+2mol×2+1mol×3=10mol,这种混合物的质量:m=3mol×58.5g·mol-1+2mol×95g·mol-1+1mol×133.5g·mol-1=499g。列比例可求得Cl-为1mol时,混合物的质量:10mol∶499g=1mol∶m,解得m=49.9g。答案3∶2∶149.93.今有Fe与Zn的混合物12.1g,与足量的稀盐酸反应共放出H24.48L(标准状况),求:(1)原混合物中Fe和Zn的质量分数?(2)反应中消耗HCl物质的量是多少?解析(1)Fe、Zn均可与盐酸反应放出H2,故生成的4.48LH2是Fe、Zn与盐酸反应放出H2的体积之和。本题可根据Fe、Zn与盐酸反应的化学方程式进行计算。H2的物质的量为:n(H2)=4.48L22.4L·mol-1=0.2mol,设原混合物中含Fe与Zn的物质的量分别为x、y,则:Fe+2HCl===FeCl2+H2↑x2xxZn+2HCl===ZnCl2+H2↑y2yy根据条件可以列如下等式:x+y=0.2molx·56g·mol-1+y·65g·mol-1=12.1g解得x=0.1moly=0.1mol所以:m(Fe)=0.1mol×56g·mol-1=5.6g,w(Fe)=5.6g12.1g×100%=46.28%m(Zn)=0.1mol×65g·mol-1=6.5g,w(Zn)=6.5g12.1g×100%=53.72%n(HCl)=2x+2y=2×(0.1mol+0.1mol)=0.4mol答案(1)w(Fe)=46.28%w(Zn)=53.72%(2)n(HCl)=0.4mol课时作业1.下列说法中错误...