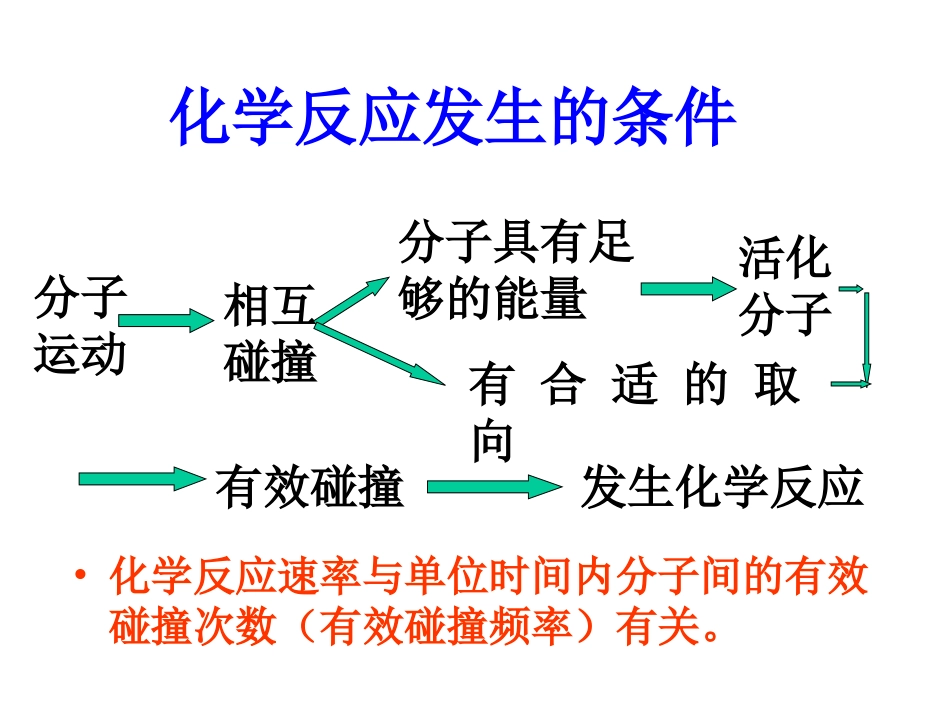
影响化学反应速率的因素回忆:化学反应的碰撞理论:⑴、化学反应的实质是:旧的化学键断裂,新的化学键形成⑵、化学反应发生的先决条件:反应物分子相互接触和碰撞注意:反应物分子之间的碰撞次数很大,但并不是每一次碰撞均可发生化学反应。在化学上,把能够发生化学反应的碰撞叫有效碰撞;不能发生化学反应的碰撞叫无效碰撞;有效碰撞次数越多,反应速率越快。分子运动相互碰撞分子具有足够的能量活化分子有合适的取向有效碰撞发生化学反应化学反应发生的条件•化学反应速率与单位时间内分子间的有效碰撞次数(有效碰撞频率)有关。实验步骤实验现象结论实验二:温度对化学反应速率的影响升高温升高温度反应度反应速率增速率增大大进行加热的先生成沉淀已知:Na2S2O4+H2SO4==Na2SO4+SO2↑+S↓+H2OP21实验2-3三、温度对反应速率的影响由Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2反应同浓度下高温首先出现混浊,说明升温可加速反应升温可加速反应。一般每升高10℃反应速率可增加2~4倍阅读课本实验2-3,总结出温度对化学反应速率的影响.结论:在其它条件不变的情况下,升温反应速率增大,降温反应速率减小为什么?实验2一3•Na2S2O4+H2SO4==Na2SO4+SO2+S↓+H2O•从实验中可以得出结论∶加热的一组首先出现浑浊。•科学探究∶碘化钾加入稀硫酸,振荡加淀粉溶液,加热的试管先出现蓝色。一方面一方面,,升高温度使分子获得更高的能量升高温度使分子获得更高的能量,,活化活化分子百分数提高分子百分数提高;;另一方面另一方面,,升高温度升高温度,,使分子间碰撞频率提高使分子间碰撞频率提高..原理解释原理解释有效碰撞几率提高有效碰撞几率提高,,反应速率增大反应速率增大..在浓度一定时,升高温度,反应物分子的能量增加,使原来一部分原来能量较低的分子变成活化分子,从而增加了反应物分子中的活化分子数,使有效碰撞次数增多,因而使反应速率增大。当然,由于升高温度,会使分子的运动加快,单位时间里反应物分子间的碰撞次数增加,反应也会相应加快,但这不是主要原因。碰撞理论解释各外界因素对速率的影响反应速率理论本质探讨分子运动相互碰撞分子具有足够能量活化分子有合适的取向有效碰撞化学反应碰撞理论n活=n总×活%一般说来,温度每升高10℃,速率增加2-4倍。T↑→普通分子变为活化分子→活%↑→n活↑→V↑温度2、把除去氧化膜的Mg条,投入到盛有稀盐酸的试管中,发现H2的产生速率(v)与时间(t)的变化情况如右图所示,•t1~t2速率变化的主要原因是:_______;•t2~t3速率变化的主要原因是:_________。vt1t2t3t其他条件不变,温度升高,反应速率加快友情提醒:温度对任何反应的反应速率皆有影响,但对于吸热或放热反应影响的程度不同,对吸热反应影响程度较大。例1、对于反应M+N→P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为()A.2minB.3minC.6minD.9minV×倍数值(t2-t1)/10=变化后的反应速率原因:温度升高分子获得更高的能量活化分子百分数提高有效碰撞次数提高反应速率加快温度对反应速率的影响升高温度活化分子的百分比增大(分子运动速率加快,碰撞频率增加)有效碰撞次数增多反应速率加快温度对反应速率的影响影响外因单位体积内有效碰撞几率化学反应速率分子总数活化分子数升高温度不变增加增加加快结论:当其它条件不变时,升高温度反应速率增大;降低温度反应速率减小。2.温度对反应速率的影响:外界条件对反应速率的影响原因:(1)浓度一定时,升高温度,分子的能量增加,使一部分普通分子转变为活化分子,从而增加了活化分子的百分数,反应速率增大,这是主要原因。规律:其他条件不变时,升高温度,可以增大反应速率,降低温度,可以减慢反应速率。(2)其次,温度升高,使分子运动的速度加快,单位时间内反应物分子间的碰撞次数增加,反应速率也会相应的加快。注意:a、温度对化学反应速率的影响对放热反应和吸热反应都适用。b、反应若是可逆反应,升高温度时,正反应速率、逆反应速率都加快。课堂练习右图表示Mg与某稀盐酸反应的速率与时间的关系曲线,试解释出现上述曲线的原因。速率...